Малюнок 1 ілюструє проект експерименту. У день 48 і 70 днів клінічні ознаки сухого ока оцінюються у імунізованих пацюків. Обсяг розриву представлений довжиною вологою частини фенольной червоної нитки. На малюнку 2 показані типові зображення фенольних червоних ниток з контрольних і щурів DED. Довжина фенольних червоних ниток в групі DED коротше контрольної групи, що вказує на менший обсяг розриву.
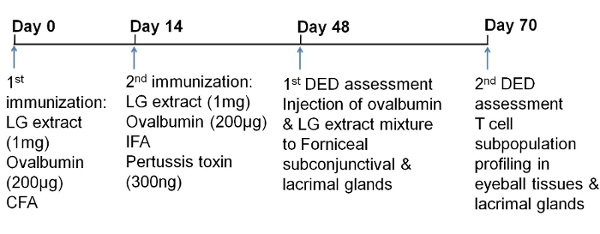
Флуоресцеїн зв'язується з пошкодженим епітелієм рогівки. Таким чином, пошкодження рогівки вимірюють фарбуванням флуоресцеїну рогівки. Флуоресцеіновие плями на поверхні рогівки щурів DED оцінювали від 0 до 2 і порівнювали з контрольними щурами. Щури з DED мають більше фарбування флуоресцеїном, ніж контрольні щури (рис. 3), що вказує на пошкодження рогівки.
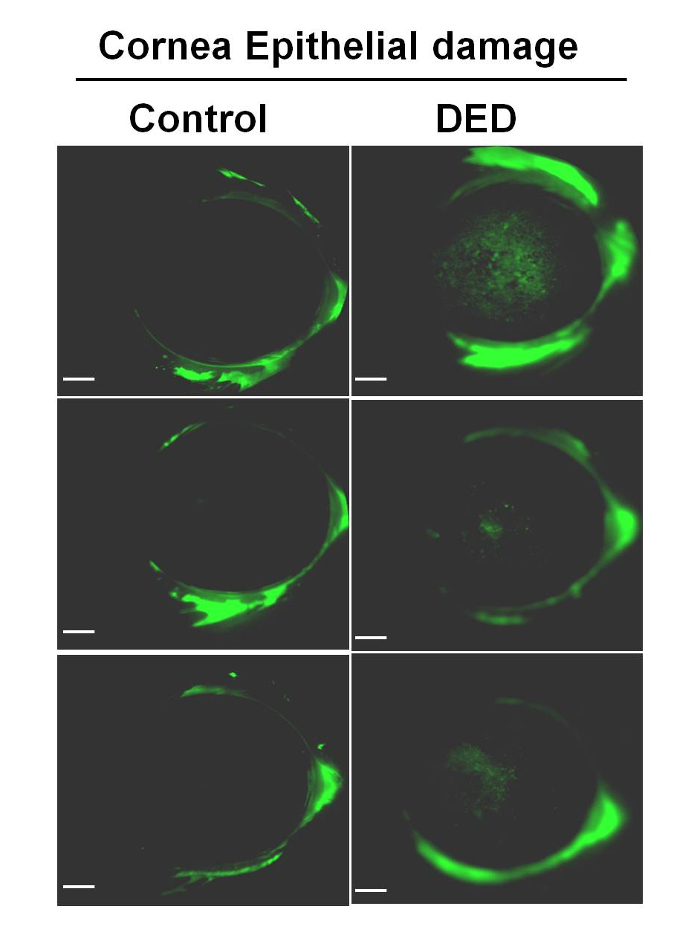
Гладкість рогівці DED і контрольні щури оцінювали за допомогою кільцевого освітлювача. Якщо поверхня рогівки гладка, з високою стійкістю до розриву, зображення кільця освітлювача на поверхні ока округле і досконале. Спотворення зображення вказує на зниження гладкості рогівки і нестабільну сльозогінний плівку. Ступінь спотворення кільця була градуйована від 0 до 2. У групі DED був відзначений більш високий рівень спотворення кільця (малюнок 4), що свідчить про меншу стабільності розриву.
Щурів визначають як сухі очі, коли принаймні дві клінічні ознаки сухого ока є ненормальними. Серед 24 імунізованих пацюків 21 щур розробили DED на 48-й день. Результати були узгоджені при оцінці на 70-й день.
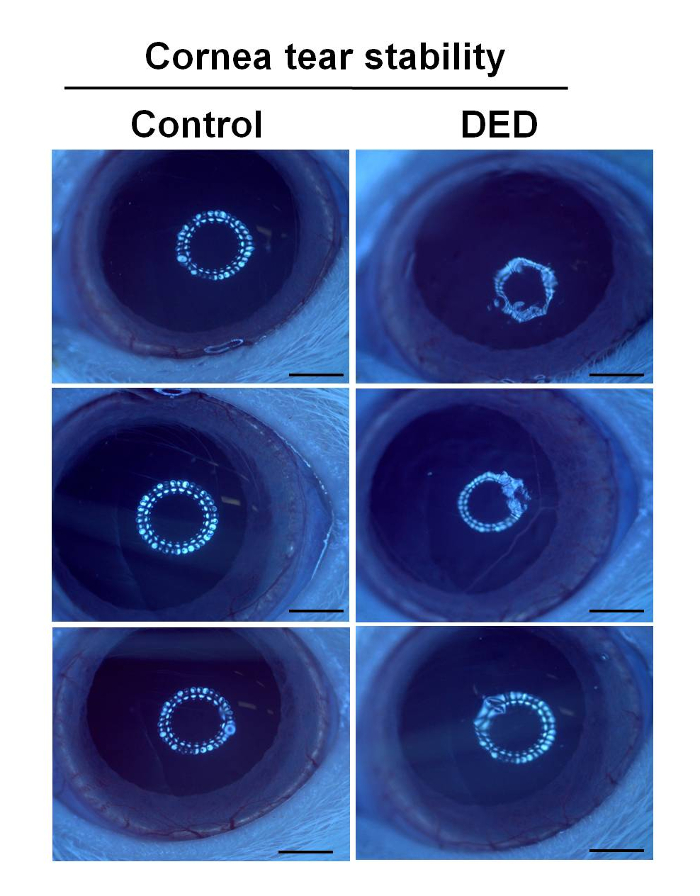
Аналіз проточної цитометрії показує, що переважаючим підмножиною Т-клітин в нормальних тканинах очного яблука щура є Т-клітини з ефекторних пам'яттю (рис. 5). В очних яблуках щурів DED ~ 70% CD3 + Т-клітини є Т-клітинами ефекторних пам'яті, тоді як у контрольних пацюків це число становить ~ 50%. Очні клітини щурів DED мають значно більш високоефективні Т-клітини пам'яті, ніж у контрольних щурів (рис. 6).
Малюнок 1: Схема експериментальної конструкції. LG: слізні залози; DED: хвороба сухого ока; CFA: повний ад'ювант Фрейнда; IFA: неповний ад'ювант Фрейнда. Натисніть тут, щоб переглянути збільшену версію цього малюнка.

Малюнок 2: Червона нитка фенолу вимірює об'єм сліз. Червону нитку фенолу поміщають в проксимальний кут очей щури протягом 1 хв і потім видаляють. RepresentativПоказани зображення фенольной червоної нитки разом з лінійкою з груп управління і DED. ImageJ використовувався для вимірювання довжини вологою частини феноло-червоних ниток. Шкала шкали = 1 мм. Натисніть тут, щоб переглянути збільшену версію цього малюнка.
Малюнок 3: Репрезентативні зображення епітеліального пошкодження рогівки, виміряні флуоресцеіновим фарбуванням. Кожна щуряча рогівка фарбувалася 0,2% флюоресцеином протягом 1 хв і промивали щонайменше 1 мл фізіологічного розчину. Зображення були зроблені під мікроскопом для візуалізації очей з кобальтові синім світлом. У першому стовпчику представлені репрезентативні зображення контрольних рогівки. У другій колонці представлені репрезентативні зображення фарбування рогівки у щурів з функціями DED. Зелені флуоресцентні плями вказують на епітелій рогівки L пошкодження. Всі зображення були зроблені в тій же кольоровій гамі. Кількісне визначення флуоресцеінового фарбування проводили відповідно до площі і щільністю зелених плям. Шкала шкали = 1 мм. Натисніть тут, щоб переглянути збільшену версію цього малюнка.
Малюнок 4: Репрезентативні зображення Cornea, що показують відображення кільцевого освітлювача. Гладкість рогівки плавника / сліз вимірювали за допомогою кільцевого освітлювача. Ступінь спотворення кільця в захоплених зображеннях є показником відносної стабільності розриву. У лівій колонці показані репрезентативні зображення у контрольних тварин, а в правій колонці показані репрезентативні зображення після індукції сухого ока. Шкала шкали = 1 мм.Ank "> Натисніть тут, щоб переглянути збільшену версію цього малюнка.
Малюнок 5: Точкові графіки, отримані з аналізу проточної цитометрії. Т-клітини, виділені з тканин очного яблука, фарбували панеллю антитіл. У CD45 + CD3 + 7AAD - популяції були виділені CD3 + 7AAD - T-клітини. Серед CD3 + 7-AAD - T-клітин визначалися наївні, центральні пам'яті і популяції T-клітин пам'яті з ефекторних пам'яттю. Натисніть тут, щоб переглянути збільшену версію цього малюнка.
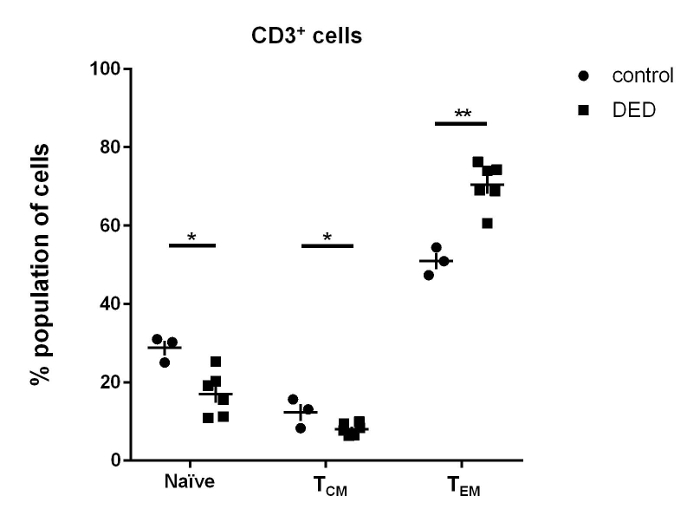
Малюнок 6: Профіль субпопуляції Т-клітин в очних яблуках. CD3 + CD45RC + Наївні Т-клітини, CD3 + CD45RC - CD44 + CD62L - клітини ефекторних пам'яті T (T EM) і CD3 + CD45RC - CD44 + CD62L + центральна пам'ять T (T CM) клітини представлені як відсоток CD3 + Т-клітин. Результати взяті у 3 контрольних щурів і у 6 щурів DED. Аналогічні результати були отримані з аналізу Т-клітин з ізольованих слізних залоз (дані не показані). Для статистичного порівняння використовувався t-тест непарного учня. Смуги помилок є SD. * P <0,05, ** p <0,01. Натисніть тут, щоб переглянути збільшену версію цього малюнка.

