Первинний рак печінки є одним з найбільш поширених злоякісних новоутворень. За різними оцінками, гепатоцелюлярна карцинома (ГЦК) займає 4-6е місце за поширеністю серед ракових пухлин, 7е місце у чоловіків і 9е у жінок серед всіх злоякісних новоутворень [1-4]. Як мінімум близько мільйона чоловік щорічно захворює ГЦК і від 500 тис. До мільйона чоловік помирає внаслідок ГЦК [1, 2, 5]. Незважаючи на останні досягнення в лікуванні ГЦК, смертність залишається високою. В середньому 1, 3 і 5-річна виживаність після радикального лікування становить 66,1; 39,7 і 32,5% відповідно [1]. Навіть при виявленні ГЦК на ранній стадії 5летняя виживання після радикального лікування становить лише 59,1% [1]. У загальній популяції хворих ГЦК 5летняя виживання становить близько 5-15,9% [5-7]. Розподіл захворюваності ГЦК по регіонах планети вкрай нерівномірно і варіює від 100 і 150 випадків на 100 000 населення в популяціях відповідно Китаю та Тайваню до 2,6-9,8 випадку на 100 000 населення в США і країнах Західної та Центральної Європи [1, 5 , 8]. Сучасні епідеміологічні дослідження вказують на зростання захворюваності ГЦК в розвинених країнах західного світу [8, 9]. Наприклад, в США за період з 1975 по 2005 рік захворюваність ГЦК потроїлася [9]. Точні дані по захворюваності ГЦК в Україні відсутні, проте якщо екстраполювати європейські дані, вона повинна складати не менше 5-10 випадків на 100 000 населення.
У більшості випадків (80-90%) ГЦК розвивається на тлі цирозу печінки [1, 10]. Продемонстровано, що ГЦК є провідною причиною смертності при компенсованому цирозі печінки [10].
Провідними етіологічними факторами ГЦК в світовому масштабі (75-80% випадків) є вірусні гепатити В (50-55%) і С (30-35%) [11]. При гепатиті С ГЦК практично завжди виникає при сформованому цирозі печінки [8, 12]. Ризик виникнення ГЦК при гепатиті С без цирозу становить 0-1,8% на рік, на тлі же цирозу він зростає до 3,7-7,1% в рік [10, 13]. При вірусному гепатиті В частота виникнення ГЦК варіює від 0,02-0,1% при беcсімптомном носійство до 2,2-4,3% при компенсованому цирозі [10, 13]. До 20% випадків ГЦК при вірусному гепатиті В виникає на тлі нецірротіческой печінки [12]. Іншими факторами ризику ГЦК є інтоксикація афлатоксином В, алкоголізм, неалкогольний стеатогепатит, цукровий діабет II типу, гемохроматоз, недостатність a1антітріпсіна, аутоімунний гепатит, первинний біліарний цироз, гіпотиреоз [2, 10, 14-17].
Макроскопічно в більшості випадків ГЦК являє собою м'яку пухлину, іноді з вогнищами некрозу або крововиливу в центрі [2, 18]. Відповідно до класифікації Еггеля виділяють три макроскопічних типу ГЦК: вузловий, масивний і дифузний [19, 20]. Незважаючи на широке поширення класифікації Еггеля, вона малопридатна в хірургічній практиці, оскільки більшість оперативних втручань з приводу ГЦК виконується при вузловому типі [20, 21]. Тому Японської групою вивчення раку печінки запропонована субклассіфікація вузлового типу ГЦК. Відповідно до неї виділяють простий вузловий тип, вузловий тип з внеузловим зростанням і зливний мультіузловой тип. Продемонстровано, що при простому вузловому типі ГЦК прогноз захворювання значно краще, ніж при двох інших типах [21, 23].
Для гістологічної оцінки пухлини найбільш часто використовують класифікацію ВООЗ. Відповідно до неї виділяють чотири типи ГЦК: високо, помірно, низько і недиференційований [20]. Виділяють наступні основні гістологічні типи зростання ГЦК: трабекулярной, псевдозалозисті і солідний [1, 20]. Також мають місце рідкісні гістологічні варіанти ГЦК: світлоклітинний, комбінована з холангіокарціноми, саркоматозние, скірозний, фіброламеллярная і ГЦК з лімфоцитарною інфільтрацією [1, 5, 20].
В ході збільшення розмірів ГЦК практично завжди відбувається її дедіфференцірованіе [24]. У пухлини з'являються клони клітин з помірною або низьким ступенем диференціювання і більш високою швидкістю проліферації, які заміщають спочатку високодиференційовану тканину [24]. При діаметрі> 3 см в переважній більшості випадків ГЦК є помірно або низькодиференційований [20].
ГЦК є агресивною, рано метастазуючою пухлиною. Навіть при розмірах ГЦК 2-3 см мікрометастази в навколишнє паренхіму печінки виявляються в 19-36% випадків [23, 25]. Фактором, що обумовлює внутрипеченочное метастазування ГЦК, є її ангіоархітектоніка. Оскільки гілки ворітної вени (ВВ) є еферентних судинами для ГЦК, різні зони печінкової паренхіми стають дренажними для пухлини і пухлинні мікросателіти заносяться в них по ходу портального кровотоку [25-27]. Також переважне виникнення метастазів ГЦК в печінці в порівнянні з іншими органами зв'язується з наявністю в печінкової паренхіми сприятливого для пухлинних клітин мікрооточення [28]. Лимфогенное метастазування не є типовим для ГЦК. Интраоперационно метастази в лімфатичні вузли виявляються у 1,7-7,45% хворих [29, 30].
Кровопостачання ГЦК в ранній і поширеною стадіях значно відрізняється. Рання ГЦК (морфологічно нечіткий вузловий тип) кровоснабжается подібно нормальної печінкової паренхіми, з гілок ворітної вени і печінкової артерії [20, 31]. Відтік крові від неї відбувається в галузі печінкових вен [20]. При прогресуванні ГЦК її ангіоархітектоніка перебудовується. Кровопостачання поширеною ГЦК відбувається виключно з басейну печінкової артерії [20, 31]. Тонкостінні печінкові вени в межах капсули швидкозростаючою пухлини швидко руйнуються [20]. В таких умовах прикордонні ГЦК гілки ворітної вени стають судинами відтоку, що підтверджується як морфологічними, так і ангіографічними дослідженнями [20, 25, 27]. Негативними наслідками реверсивного портального кровотоку від пухлини є внутрипеченочное метастазування ГЦК і часте виникнення пухлинного тромбозу ворітної вени [20]. При діаметрі ГЦК> 5 см інвазія гілок ворітної вени зустрічається більш ніж в половині випадків [32]. При інвазії ГЦК в великі гілки печінкових вен також можливий їх пухлинний тромбоз з поширенням в нижню порожнисту вену [33].
Лікування ГЦК є складною терапевтичної завданням. У зв'язку з резистентністю пухлини до системної хіміотерапії тільки радикальні резекційну втручання можуть надати хворим шанс на довготривалу виживаність [34-36]. Удосконалення хірургічної техніки і періопераційної інтенсивної терапії дозволило значно знизити ризик післяопераційних ускладнень і летальність [37]. В сучасних хірургічних гепатологічних центрах смертність після стандартних резекцій печінки з приводу ГЦК не перевищує 10%, а віддалена 5летняя виживання хворих досягає 40-50% [35, 38, 39]. Однак внаслідок значної поширеності пухлинного процесу, наявності віддалених метастазів і пухлинної інвазії магістральних судин черевної порожнини резекції печінки здійсненні тільки у 30% хворих [38, 39].
Пухлинна інвазія ворітної вени є типовим ускладненням ГЦК і зустрічається в двох формах - у вигляді пухлинного тромбозу і прямого проростання пухлиною стінки судини. Пухлинний тромбоз ВВ є специфічною особливістю ГЦК, яка не характерна для інших типів пухлин печінки, як первинних, так і метастатичних [40, 41]. Виникнення тромбозу ворітної вени призводить до погіршення функціонування печінкової паренхіми, розвитку синдрому портальної гіпертензії, асциту, розриву варикозних вен стравоходу, масивного внутрішньопечінкового метастазування (рис. 1) і в результаті - до ранньої загибелі хворих [1]. Якщо медіана виживаності при ГЦК без макроваскулярних інвазії становить 24,4 міс., То при ГЦК, ускладненої тромбозом ВВ, - тільки 2,7 міс. Будь-яка форма пухлинного ураження ВВ при ГЦК, за матеріалами більшості сучасних посібників і публікацій, є протипоказанням до радикального хірургічного лікування [40, 41]. У той же час тромбоз гілок ворітної вени 1го порядку або її конфлюенса за відсутності локального або віддаленого метастазування має місце в 4,6-15,5% випадків, і ці хворим потенційно можна виконати радикальне втручання [37, 42].
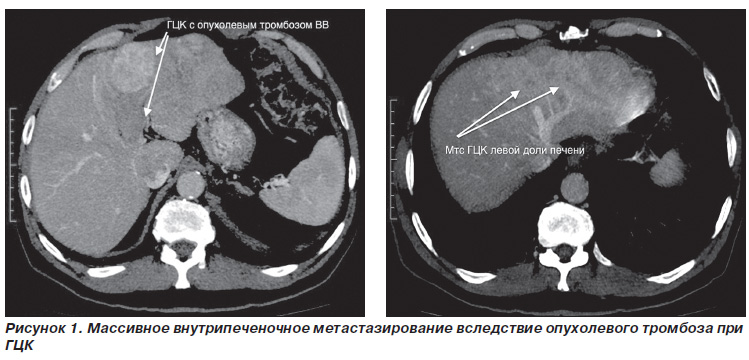
Очевидна неефективність консервативних методів лікування і вкрай поганий прогноз захворювання при ГЦК з інвазією ворітної і нижньої порожнистої вен зумовлюють високу актуальність проблеми і диктують необхідність проведення подальших досліджень в даній області.
Метою даного дослідження був аналіз результатів хірургічного лікування хворих гепатоцелюлярної карциномою з пухлинної інвазією ворітної і нижньої порожнистої вен.
Матеріал і методи
У дослідження включені 84 хворих з ГЦК, яким в період з січня 2003 р по грудень 2012 р виконані радикальні резекції печінки (табл. 1). Пацієнти з пухлинами стовбура, біфуркації або пайових гілок ВВ 1го порядку (22 чол.) Склали основну групу. У 16 хворих мав місце пухлинний тромбоз ВВ, у 6 - пряма інвазія ГЦК в ВВ. Для оцінки поширеності пухлинної інвазії ВВ ми використовували класифікацію Shi (2007) (табл. 2) [43]. Група порівняння складалася з 62 хворих з пухлинами гілок ВВ 2-5го порядку.
Дослідження носило проспективний характер. Хворі ГЦК включалися в дослідження при задоволенні наступними критеріями:
а) функціональний клас А по ChildPugh;
б) ICG R15 <30%;
в) обсяг залишається частини печінкової паренхіми більше 30%;
г) рівень аланін і аспартатамінотрансферази ≤ 100 МО.
Хворі з віддаленими метастазами, метастазами в лімфовузли та інвазією пухлини в жовчовивідні шляхи з дослідження були виключені.
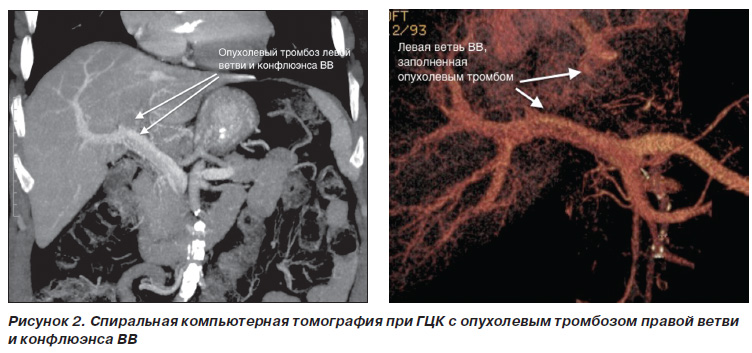
Діагноз ГЦК до операції встановлювався на підставі даних комп'ютерної томографії (КТ) з трифазним контрастуванням і підтверджувався післяопераційним гістологічним дослідженням. Доопераційна біопсія пухлини рутинно не виконувалася. Діагноз пухлинної інвазії ворітної вени і нижньої порожнистої вени встановлювався до 2008 р на підставі даних целіакомезентерікопортографіі і каваграфія. Після 2008 р в зв'язку з впровадженням в нашому інституті сучасної мультідетекторний спіральної комп'ютерної томографії з 2D і 3Dмоделірованіем (рис. 2), необхідність у виконанні інвазивних ангіографічних досліджень відпала. В післяопераційному періоді контроль прохідності магістральних судин черевної порожнини здійснювали за допомогою допплерівського УЗісследованіе на 1е, 3і і 7е добу після операції. Функціональний стан паренхіми печінки до операції оцінювали за допомогою тесту кліренсу індоціанін зеленого (ICG R15).
В післяопераційному періоді пацієнти кожен квартал проходили УЗД органів черевної порожнини (ОЧП) та дослідження рівня aфетопротеіна, кожне півріччя - КТ ОЧП і органів грудної клітини в умовах клініки.
Порівняльну оцінку результатів дослідження проводили між трьома групами хворих з використанням ПЗ MS Exсel 2008. Віддалену актуаріальному виживання обчислювали за методом Каплана - Мейєра.
Хірургічна техніка. У групі порівняння виконувалися анатомічні резекції печінки по відомим принципам. Хірургічна техніка оперативних втручань в основній групі мала ряд особливостей.
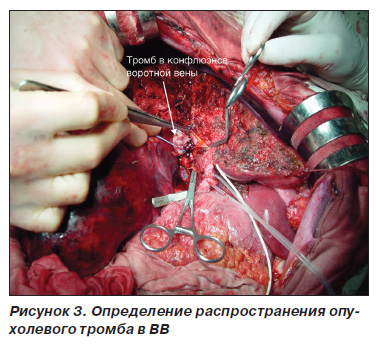
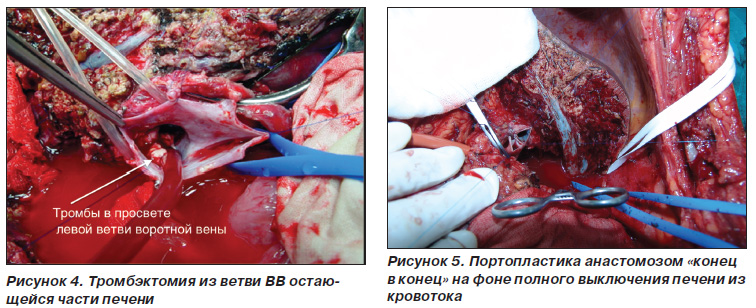
Резекція ворітної вени і портопластіка. Під час диссекции гепатодуоденальной зв'язки стовбур ворітної вени виділяли з навколишніх тканин максимально в проксимальному напрямку до конфлюенса верхньої брижової і селезінкової вен. Щоб уникнути фрагментації тромбів ворітної вени з подальшою їх дислокацією та диссеминацией виділення елементів печеночнодвенадцатіперстной зв'язки виконували делікатно. Трансфіссурально виділяли конфлюенс загального печінкового протоку, жовчні протоки видаляється частини печінки лігували і перетинали. Після цього з'являлася можливість доступу до конфлюенсу ВВ і гілки ВВ залишається частини печінки, що лежить дистально по відношенню до тромбу. Після внутрішньовенного введення 500 мг гідрокортизону одночасно віджимати стовбур і контралатеральную гілка ворітної вени, потім перерізали собі просвіт ворітної вени для ідентифікації поширеності пухлинного тромбу (рис. 3). Ворітну вену перетинали вище і нижче рівня поширення тромбу, препарат видаляли. При поширенні пухлинного тромбу в галузі ВВ залишається частини печінки виконували тромбектомію з них (рис. 4). У 20 випадках портопластіку здійснювали на збереженому артеріальному кровотоку в решти частини печінки. У 2 випадках в зв'язку з невеликою довжиною гілки ВВ залишається частини печінки і відсутністю можливості взяти її в затиск портопластіку виконували на фоні повного виключення печінки з кровотоку (рис. 5). Оскільки портальні гілки, кровоснабжающие хвостату частку печінки, беруть початок від стовбура ВВ або її конфлюенса, при пухлинному ураженні цих ділянок ВВ тотальна каудальная лобектомія була обов'язковим елементом оперативного втручання. При прямій інвазії ГЦК в конфлюенс ВВ оперативне втручання проводили за тими ж принципами.
Способи відновлення портального тракту. В основній групі хворих в залежності від протяжності пухлинної інвазії нами використовувалися наступні варіанти резекції ВВ і портопластікі (табл. 3): резекція конфлюенса з анастомозом «кінець в кінець» (рис. 5), клинчасте висічення стінки ВВ з подальшим поперечним швом, висічення стінки ВВ з аутовенозного пластикою сегментом оваріальної вени.
Результати та обговорення
У хворих основної групи виконані 14 великих і 8 розширених резекцій печінки в поєднанні з резекцією конфлюенса ВВ (табл. 4). Із запропонованих варіантів відновлення портального тракту найбільш часто (17 випадків) використовувалася портопластіка анастомозом «кінець в кінець» (табл. 3). У хворих групи порівняння виконані 42 великих (більше 3 сегментів), 14 розширених (більше 5 сегментів) резекцій і 6 резекцій двох сегментів печінки (табл. 4).
В основній групі середня тривалість операції склала 380 хв, час сумарною ішемії печінки - 60 хв, інтраопераційна крововтрата - 1920 мл. Середній час, необхідне для резекції і реконструкції ВВ, склало 22 хв. У групі порівняння середня тривалість операції склала 310 хв, час сумарною ішемії печінки - 52 хв, інтраопераційна крововтрата - 1560 мл. Збільшення обсягу крововтрати в основній групі по відношенню до групи порівняння ми пов'язуємо з наявністю у хворих з пухлинами ВВ синдрому портальної гіпертензії, а також з підвищеною кровоточивістю внаслідок гіршого функціонального стану печінки. Середня тривалість перебування хворого в стаціонарі була довше у хворих основної групи (25 діб) по відношенню до групи порівняння (13 діб).
Характер і кількість післяопераційних ускладнень представлені в таблиці 5. Достовірно частіше в основній групі зустрічався синдром малої печінки, що пояснюється великою кількістю великих і розширених резекцій печінки. Післяопераційна летальність була незначно вище в основній групі по відношенню до групи порівняння. У групі порівняння померло 5 хворих (2 - інфаркт міокарда, 1 - геморагічний інсульт, 1 - перфорація гострих виразок товстої кишки, 1 - поліорганна недостатність). В основній групі померло 2 хворих (1 - тромбоз ВВ, 1 - сепсис). Тромбоз ВВ після портопластікі мав місце в одному випадку і привів до поширеного некрозу печінкової паренхіми і смерті хворого.

У хворих основної групи пухлина відповідала Т3b за класифікацією TNM в 18 випадках (81,8%), T4 (проростання вісцеральної очеревини) - в 4 (18,1%) випадках, в групі порівняння в 11 (17,7%) випадках пухлина відповідала Т2, в 45 (72,6%) випадках - Т3а (кілька вогнищ більше 5 см) і в 6 (9,7%) випадках - Т4 (проростання вісцеральної очеревини). Наявність капсули у пухлини відзначено в 17 (77,3%) випадках в основній групі і в 39 (62,9%) в контрольній групі. Інвазія пухлинного тромбу в стінку ВВ виявлена у всіх хворих основної групи (рис. 6). Таким чином, онкологічна стадийная характеристика пухлини хворих контрольної групи була значно краще (менша поширеність і інвазія пухлини).

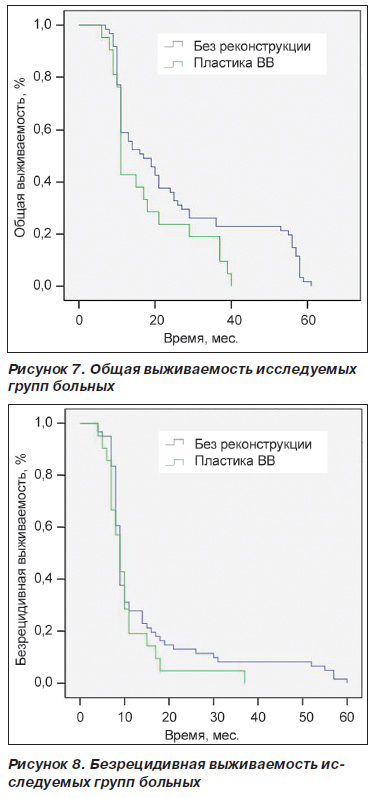
Загальна виживаність протягом 12 і 36 міс. в групі порівняння була більшою в порівнянні з хворими, яким виконувалися резекція і пластика ВВ, і склала 59 і 26% відповідно (рис. 7). У групі хворих з інвазією ВВ загальна виживаність протягом 1 року склала 43% і 3 років - 19%. Також безрецидивної виживаність протягом 12 і 36 міс. була вищою у хворих групи порівняння - відповідно 27,8% (1 рік) і 8,2% (3 роки) (рис. 8). У хворих з інвазією ВВ вона склала 19% (1 рік) і 4,8% (3 роки) відповідно.
Ще до недавнього часу наявність пухлинної інвазії магістральних венозних судин черевної порожнини при ГЦК вважалося абсолютним протипоказанням до радикального оперативного втручання. Автори, що мали початковий досвід комбінованих операцій - резекцій печінки з судинними резекцію, відзначили, що дані втручання супроводжуються високим хірургічним ризиком і летальністю. Незадоволеність виживання в віддаленому періоді стала стимулом до пошуку нових шляхів поліпшення результатів лікування ГЦК, інвазірует магістральні венозні судини. У нашому центрі прийнята агресивна хірургічна тактика лікування даної категорії хворих. У зв'язку з виконанням в нашому центрі ортотопічної трансплантації печінки від живого родинного донора нами накопичені необхідні навички оперативних втручань на ВВ. Завдяки використанню трансплантаційних технологій нам вдалося скоротити час оперативного втручання та мінімізувати ризики, пов'язані з судинним етапом оперативного втручання. Летальність в групах хворих з пластикою ВВ лише кілька перевищувала таку в групі порівняння. Ми пов'язуємо цей факт в першу чергу не з резекцією і пластикою судин, а з великим числом великих і розширених резекцій печінки в порівнянні з контрольною групою.
З огляду на велику поширеність пухлинного процесу в основній групі, віддалена загальна і безрецидивної виживаність була прогнозовано нижче, ніж в групі порівняння. Однак беручи до уваги, що тривалість життя неоперованих хворих ГЦК з інвазією ВВ рідко перевищує 2-3 міс., Досягнутий рівень віддаленій виживаності ми вважаємо прийнятним.
Таким чином, агресивна хірургічна тактика при гепатоцелюлярної карциноми з пухлинної інвазією ВВ забезпечує максимальну радикальність оперативного втручання при прийнятному кількості післяопераційних ускладнень, дозволяє значимо збільшити віддалену виживаність хворих.

