Операцією вибору в лікуванні гриж стравохідного отвору діафрагми (ГПОД) і гастроезофагеальної рефлюксної хвороби (ГЕРХ) є лапароскопічна пластика стравохідного отвору (ПІД) і фундоплікація. В даний час питання вибору методу пластики ПІД є одним з найбільш діскутабельнимі питань. Дані літератури демонструють високу частоту рецидивів гриж і ГЕРБ, аж до 42%, особливо після крурорафія [4, 7-10, 13]. Були розроблені різні методики пластики ПІД сітчастими трансплантатами, і кілька досліджень показали їх переваги [1, 6, 7, 9, 12]. Незважаючи на це, питання необхідності застосування сіток і конкретних методик аллопластики залишаються спірними, тому що використання аллотрансплантатов може призводити до стравохідним ускладнень [5, 7, 8, 14]. Також не визначений точний критерій для класифікації ГПОД, хоча така необхідна, тому що частота рецидивів сильно залежить від розміру грижового дефекту, і на цьому повинен бути заснований метод пластики.
Цілі роботи: 1) аналіз віддалених результатів (в даній роботі - анатомічних рецидивів і дисфагії) лапароскопічної пластики ПІД; 2) розробка та обґрунтування нової класифікації ГПОД, заснованої на площі поверхні стравохідного отвору діафрагми (ПППОД); 3) визначення найбільш оптимального методу пластики ПІД при різних типах ГПОД. Дизайн роботи - обсерваційне дослідження.
Матеріал і методи
З 1994 по 2011 рік лапароскопічні операції з приводу ГПОД і ГЕРБ були виконані у 1780 хворих однією бригадою хірургів. Для статистично коректного аналізу з числа цих пацієнтів були виключені:
1) 300 хворих, оперованих з 1994 по 2000 рік ( «крива навчання»);
2) 68 хворих з дискінезіями стравоходу;
3) 29 хворих з ризиком анестезії ASA III і IV изза важкої супутньої патології та з віком понад 75 років;
4) 316 хворих з фундоплікаціей по Тупе (256), Розетті (25), Дору (35) (тобто аналізу піддані тільки пацієнти з фундоплікаціей по Ниссену);
5) 99 хворих з ГЕРХ без ГПОД і 109 хворих з ГЕРХ і ГПОД I типу I ступеня по Петровському.
Таким чином, проаналізовані результати 787 операцій. З них ГПОД I типу II ступеня мали місце у 185 хворих, ГПОД I типу III ступеня - у 278, ГПОД II типу - у 48, ГПОД III типу - у 264, ГПОД IV типу - у 12 хворих. Далі хворі були розділені на 3 групи відповідно до нової класифікації в залежності від ПППОД (табл. 1), за методикою Granderath і співавт. (2007) [10].
I групу склали 343 пацієнта з ПППОД менше 10 см2 (малі ГПОД), яким виконувалася тільки крурорафія. II група - 358 пацієнтів з ПППОД 10-20 см2 (великі ГПОД), яким виконувалася як крурорафія (103 хворих), так і пластика ПІД сітчастим трансплантатом в поєднанні з крурорафія (255 хворих: у 97 - onlay пластика поліпропіленовим трансплантатом Prolene, у 158 - оригінальна методика sublay пластики полегшеним композитним трансплантатом Ultrapro). III група - 86 пацієнтів з ПППОД більше 20 см2 (гігантські грижі), яким виконувалася тільки пластика ПІД сітчастим трансплантатом в поєднанні з крурорафія (у 32 - onlay пластика, у 54 - оригінальна методика) (табл. 1).
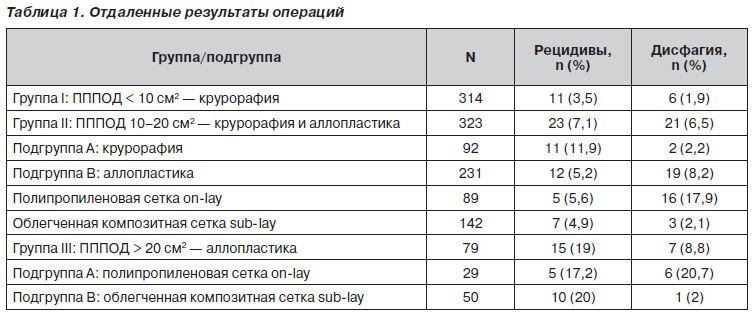
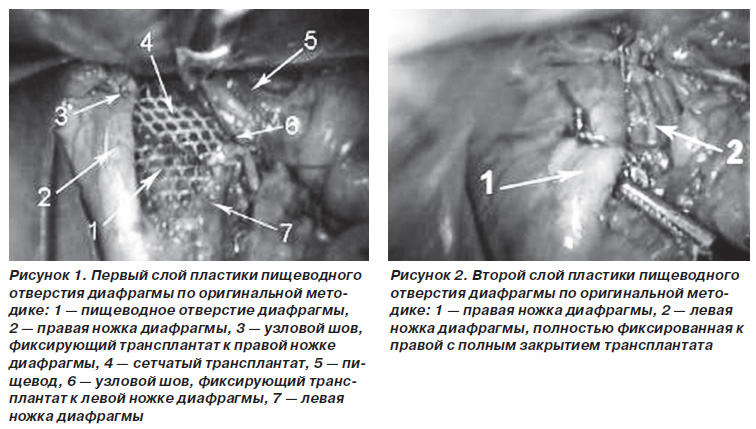
Техніка оригінальної методики двуслойной пластики ПІД полегшеним композитним (частково розсмоктується) трансплантатом докладно описана в наших попередніх публікаціях і неодноразово представлялася на міжнародних конгресах. Ключовим моментом пластики є розташування трансплантата позаду ніжок діафрагми так, щоб його край не контактував з стравоходом, з подальшою крурорафія, що закриває трансплантат. Протягом 4-8 тижнів волокна трансплантата частково розсмоктуються, що дозволяє запобігти подальшому рубцювання ПІД і стравоходу. Пластика ПІД полегшеними композитними сітчастими трансплантатами є перспективною методикою, і, можливо, саме вона стане оптимальною, оскільки ефективно запобігає як рецидиви, так і стравоходу ускладнення.
Методи дослідження включали опитувальники симптомів, рентгенологічне обстеження, ендоскопічне дослідження і добовий внутріпіщеводного рНмоніторінг.
Статистичний аналіз. Аналіз частоти рецидивів і дисфагії, що фігурує в даній роботі, проведений за допомогою критерію хіквадрат. Порівнянні групи виявилися порівнянними за демографічними показниками (вік, стать, клас ASA) і передопераційним даними. Обробка даних проведена з використанням програми StatSoft Statistica 10.0.
Результати та обговорення
Віддалені результати вивчені в середньому через 32 місяці (10-60) у 716 пацієнтів (90,9%).
У I групі рецидиви мали місце у 11 хворих (3,5%), а дисфагія - у 6 хворих (1,9%). У II групі рецидиви мали місце у 23 пацієнтів (7,1%), дисфагія - у 21 пацієнта (6,5%). Порівнюючи частоту рецидивів у хворих I групи і підгрупи A II групи, ми отримали достовірну різницю на користь першої: 11 хворих (3,5%) проти 11 хворих (11,9%) (p = 0,0016). Між підгрупами II групи були достовірні відмінності за частотою як рецидивів (11 (11,9%) проти 12 (5,2%) (p = 0,0212) на користь аллопластики), так і дисфагії (2 (2,2%) проти 19 (8,2%) (p = 0,0446) на користь крурорафія). Порівнявши 2 різні методики в межах підгрупи В, ми не побачили достовірних відмінностей по частоті рецидивів (5 (5,6%) проти 7 (4,9%) (p = 0,8185)), але отримали достовірне відміну по частоті дисфагии в користь оригінальної методики (16 (17,9%) проти 3 (2,1%) (p = 0,0001)). У III групі частота рецидивів склала 19% (15 хворих), а дисфагии - 8,8% (7 хворих). Порівнюючи результати аллопластики в цій групі з підгрупою В II групи, ми отримали достовірну відмінність на користь великих гриж (15 (19%) проти 12 (5,2%) (p = 0,0002)), у той час як по частоті дисфагии достовірних відмінностей не було (7 (8,98%) проти 19 (8,2%) (p = 0,2046)). Аналогічно II групі, порівнюючи підгрупи III групи (пластику поліпропіленовою сіткою з оригінальною методикою), ми не побачили достовірних відмінностей по частоті рецидивів (10 (20,0%) проти 5 (17,2%) (p = 0,7632)), але отримали достовірне відміну по частоті дисфагии на користь оригінальної методики (6 (20,7%) проти 1 (2,0%) (p = 0,0048)).
Вивчення віддалених результатів лапароскопічних операцій з приводу ГЕРХ і невеликих ковзають ГПОД показує, що частота успішних втручань коливається в межах 80-90% [3]. При цьому завжди використовується крурорафія, і анатомічні рецидиви рідкісні. Навпаки, частота рецидивів після пластики великих і гігантських змішаних і параезофагеальних ГПОД залишається високою. Нещодавно опублікований метааналіз показав, що середня частота анатомічних рецидивів таких гриж соcтавляет 25%, досягаючи у деяких авторів 42% [13]. Подібні результати продемонстрував і ряд оглядових статей: за даними Draaisma і співавт. (2005), середня частота рецидивів була 7% (0-42); за даними Johnson і співавт. (2006), у пацієнтів, які перенесли крурорафія, середня частота рецидивів склала 10,7% (0-26) [4, 11]. Тому однією з найбільш актуальних завдань сучасної лапароскопічної хірургії є розробка оптимальних методик пластики великих і гігантських ГПОД.
Для зменшення високої частоти рецидивів до пластики ПІД була застосована технологія аллопластики. Це дозволило істотно знизити частоту рецидивів. Frantzides і співавт. (2002) в проспективному рандомізованому дослідженні, порівнює пластику політетрафлюоретіленовим (ПТФЕ) трансплантатом з крурорафія, отримали достовірне зниження частоти рецидивів у групі ПТФЕпластікі: 0 проти 22% [6]. Потім Granderath і співавт. (2005) порівняли пластику поліпропіленовим трансплантатом з крурорафія в проспективному рандомізованому дослідженні; частота рецидивів виявилася достовірно нижче в групі аллопластики: 8 проти 26% [9]. В огляді Johnson і співавт. (2006) було показано, що середня частота рецидивів знижується при використанні аллопластики в порівнянні з крурорафія: 10,7% проти 1,9% [11]. Інші огляди демонструють подібні результати [4, 7, 14]. Однак слід звернути увагу, що в більшості публікацій термін «рецидив» точно не визначений. З одного боку, не у всіх аналізованих роботах було рутинно використано рентгенологічне дослідження при оцінці віддалених результатів [4]. В результаті частота рецидивів в 1,5-2 рази вище в роботах, де рентгеноскопія стравоходу виконувалася в більш ніж 75% випадків [4]. C іншого боку, частина пацієнтів з повною або практично повною неспроможністю пластики з міграцією проксимальної частини шлунка і фундоплікаціонной манжетки в середостіння не відчувають яких-небудь болів або симптомів ГЕ [1, 4]. Якщо у них не виявляється рефлюксезофагіт і добовий внутріпіщеводного рНмоніторінг показує нормальні значення, такий рецидив слід виділяти в окремий тип - безсимптомний істинний рецидив, тому що більшість таких пацієнтів не потребуватимуть реопераций. Навпаки, при комбінації рецидиву грижі і рецидиву ГЕРХ або рецидиву грижі з больовим синдромом або дисфагией - симптомно істинному рецидиві, як правило, показана повторна операція. Також на відміну від описаних істинних рецидивів при рентгенологічному обстеженні може бути виявлена невелика безсимптомна змінна або параезофагеальние грижа. З урахуванням вихідного розміру грижового дефекту немає нічого дивного, що такий невеликий «рецидив» виникає через деякий час після пластики. Такі грижовоговипинання, напевно, повинні називатися помилковими рецидивами, якщо вони дійсно безсимптомно і не збільшуються з часом. Як приклад Andujar і співавт. (2004) доповіли про виявлення невеликих безсимптомних ковзають гриж у 20% оперованих пацієнтів, при цьому ні в одному випадку вони не зажадали реопераций [1]. Таким чином, для чіткої оцінки ефективності того чи іншого методу пластики великих і гігантських ГПОД необхідні уніфіковані поняття типів рецидивів. У даній роботі ми аналізували частоту симптомних справжніх рецидивів.
Хоча аллопластика зменшує частоту рецидивів, вона може викликати ряд ускладнень з боку стравоходу, не характерних для крурорафія: тривала функціональна дисфагія, рубцеві стриктури стравоходу і аррозии стравоходу трансплантатом. За даними літератури, стійка дисфагія, пов'язана з впливом трансплантата, не перевищує 10%. У проспективному рандомізованому дослідженні Granderath і співавт. (2005) частота дисфагии в групі аллопластики була достовірно вище, ніж в групі крурорафія: 35,3 проти 19,8% [9]. Однак при оцінці віддалених результатів через 1 рік після операції ці відсотки вже достовірно не відрізнялися: 4,9 проти 4,4% [8]. Опитування членів SAGES, опублікований Frantzides і співавт. (2010), показав, що поліпропіленові, а також ПТФЕ сітчасті трансплантати характеризуються найбільшим відсотком стравохідних ускладнень, хоча вони характеризуються найменшим відсотком рецидивів [5]. Цікаво, що в даному дослідженні проміжне положення в плані рецидивів і стравохідних ускладнень займають полегшені трансплантати [5]. На щастя, важкі рубцеві стриктури і аррозии стравоходу зустрічаються не так вже й часто, хоча деякі автори описують фатальні ускладнення аллопластики ПІД [7, 14]. В результаті для зменшення ризику розвитку цих ускладнень була запропонована ксенопластику. Проспективне рандомізоване дослідження Oeschlager і співавт. (2011) показало несуттєву різницю в плані частоти рецидивів між біологічним трансплантатом і крурорафія, але в той же час не побачило жодного випадку стравохідних ускладнень при використанні ксенопластику [12]. Подібні дані були отримані і Frantzides і співавт. (2010) [5]. Інші літературні дані і висновки учасників міжнародних конгресів сходяться на думці, що використання біологічних трансплантатів недоцільно при великих і гігантських ГПОД изза високого відсотка рецидивів і їх високу вартість. Виходячи з вищесказаного, можна підсумувати: в літературі в даний час є чітка установка, що великі і гігантські грижі потребують аллопластике, але пошук оптимальних трансплантатів та методу їх фіксації з метою профілактики стравохідних ускладнень триває.
На наш погляд, якщо аллопластика несе ризик розвитку ускладнень, необхідні чіткі показання до її використання. Як передбачається більшістю авторів, основний критерій для використання сіток - великий розмір грижового дефекту. Першими, хто визначив, що пороговий рівень між діаметрами малих і великих гриж становить 5 см, були Champion та співавт. (1998) [2]. Вони отримали велику частоту рецидивів в останній групі, і після цього більшість фахівців стали виконувати пластику ПІД сітчастим трансплантатом, коли діаметр грижового дефекту перевищував 5 см. Опитування членів SAGES, опублікований Frantzides і співавт. (2010), підтвердив це: 45% респондентів використовують розмір грижового дефекту як основний критерій для застосування аллопластики, а 50% з них застосовують сітку при діаметрі ПІД більше 5 см [5]. Вимірювання площі поверхні стравохідного отвору діафрагми було вперше описано Granderath і співавт. (2007), і цей показник є більш точним, ніж діаметр [10]. Автори підбирали метод пластики, орієнтуючись на ПППОД, і показали, що чим більше цей показник, тим більший відсоток рецидивів і тим вагоміше показання до аллопластике [11]. Метод визначення ПППОД заснований на вимірюванні поперечного та поздовжнього розміру ПІД після повної мобілізації його країв і розрахунку показника за наступною формулою: ПППОД = arcsin (ПР / 2 / ВР). ВР2, де ВР - вертикальний розмір, ПР - поперечний розмір [10]. Наш великий досвід застосування різних методів лапароскопічної пластики ПІД також навів нас до думки, що частота рецидивів сильно залежить від розмірів грижового дефекту. Тому ми створили нову класифікацію ГПОД залежно від ПППОД. Ми вважаємо, що ця класифікація дозволить уніфікувати методи пластики не тільки серед практичних лікарів, а й серед учених, публікації яких присвячені цій складній проблемі. Завершення до теперішнього часу роботи першого рівня доказовості не ставили первинною метою вивчення залежності результатів операцій від розмірів ПОД. Наприклад, в роботі Frantzides і співавт. (2002) хоча і показано достовірне зменшення частоти рецидивів при аллопластике в порівнянні з крурорафія, але дослідження включало тільки пацієнтів з діаметром ПІД 8 см і більше, тобто не ясно, чи зберігається цей ефект при меншому діаметрі, скажімо, від 5 до 8 см [6].
Повертаючись до отриманих нами даними, можна сказати, що результати в I групі (і рецидиви, і дисфагія) є задовільними, відповідають літературним [4, 10]. Вони навряд чи можуть бути значно поліпшені, в т.ч. за рахунок аллопластики, тому що при малих ГПОД (ПППОД <10 см2) вона не виправдана. У II групі рецидиви мали місце в 7,1% випадків, що закономірно для великих гриж, як вже обговорювалося вище. У цій групі дисфагія мала місце в 6,5% випадків, що також закономірно з урахуванням застосування сітчастого трансплантата, як було показано раніше. Порівнюючи частоту рецидивів у хворих I групи і підгрупи A II групи, ми отримали достовірну різницю на користь першої, що тягне за собою важливий висновок: при ПППОД 10-20 см2 різко зростає відсоток рецидивів при використанні крурорафія, що підтверджує правильність і практичну значимість поділу гриж на малі і великі по ПППОД. Отже, при малих ГПОД крурорафія адекватна, при великих - очевидно, необхідна пластика сітчастим трансплантатом. Далі між підгрупами II групи були достовірні відмінності за частотою як рецидивів на користь аллопластики, так і дисфагії на користь крурорафія. Перше ще раз підтверджує правильність запропонованої класифікації та необхідність використання при великих ГПОД для профілактики рецидивів аллопластику, друге демонструє необхідність пошуку оптимального сітчастого трансплантата для профілактики стравохідних ускладнень. Порівнявши 2 різні методики в межах підгрупи В, ми не побачили достовірних відмінностей по частоті рецидивів, але отримали достовірне відміну по частоті дисфагии на користь оригінальної методики, що вже неодноразово звучало в наших роботах і доповідях і ще раз дозволяє зробити висновок про доцільність використання саме цієї методики (sublay пластики полегшеним композитним трансплантатом) при великих ГПОД. Щоб зробити остаточний висновок не тільки про більшу ефективність оригінальної методики (чим крурорафія) в плані профілактики рецидивів при великих ГПОД, а й порівнянної з крурорафія безпеки в плані стравохідних ускладнень, нами заплановано проведення відповідного проспективного рандомізованого дослідження.
У III групі частота рецидивів досягла 19%, що характерно для гігантських гриж за даними світової літератури, як вже обговорювалося вище, і, звичайно, вимагає подальшого поліпшення. Порівнюючи результати в III групі з підгрупою В II групи, ми побачили достовірне відміну по частоті рецидивів на користь великих гриж, в той час як по частоті дисфагии достовірних відмінностей отримано не було. Аналогічно II групі, цей результат підтверджує доцільність поділу ГПОД на великі і гігантські (ПППОД> 20 см2) не тільки на підставі розміру і технічних труднощів, які супроводжують мобілізацію структур, а в першу чергу на підставі різкого зростання частоти рецидивів при гігантських грижах в порівнянні з великими , незважаючи навіть на пластику сіткою. Таким чином, пластика сітчастим трансплантатом виразно показана при гігантських грижах, але потрібне вдосконалення методик для зменшення відсотка рецидивів. Основний курс тут - створення нових трансплантатів, які б надійно утримували діафрагмальний каркас для профілактики рецидиву і в той же час не викликали б стравохідних ускладнень. Проблема в даний час полягає в тому, що наявні на сьогодні в арсеналі хірургів трансплантати не відповідають обом критеріям, тому пошук нових технічних рішень триває. Так само, як і в II групі, порівнюючи підгрупи III групи (пластику поліпропіленовою сіткою з оригінальною методикою), ми не побачили достовірних відмінностей по частоті рецидивів, але отримали достовірне відміну по частоті дисфагии на користь оригінальної методики. Це ще раз підтверджує, що оригінальна методика безпечна в плані стравохідних ускладнень і тому заслуговує широкого визнання.
Висновки
1. На підставі отриманих достовірних відмінностей в частоті рецидивів в залежності від ПППОД для вибору методу пластики необхідно вимірювати відповідний показник і користуватися розробленою класифікацією.
2. При малих ГПОД (ПППОД <10 см2) оптимальним видом пластики ПІД є крурорафія.
3. При великих ГПОД (ПППОД 10-20 см2) оптимальним видом пластики ПІД представляється оригінальна методика sublay пластики полегшеним композитним трансплантатом.
4. При гігантських ГПОД (ПППОД> 20 см2) оригінальна методика sublay пластики полегшеним композитним трансплантатом дає результати, порівнянні з даними світової літератури, але потребують покращення шляхом розробки більш ефективних і безпечних видів пластики.
список літератури
1. Andujar JJ Laparoscopic repair of large paraesophageal hernia is associated with a low incidence of recurrence and reoperation / Andujar JJ, Papasavas PK, Birdas T. [et al.] // Surgical endoscopy. - 2004. - Vol. 18. - P. 444447.
2. Champion JK Hiatal size and risk of recurrence after laparoscopic fundoplication [abstract] / Champion JK, McKernan JB // Surgical endoscopy. - 1998. - Vol. 12. - P. 565 570.
3. Dallemagne B. Clinical results of laparoscopic fundoplication at ten years surgery / Dallemagne B., Weerts J., Markiewicz S. [et al.] // Surgical endoscopy. - 2006. - Vol. 20. - P. 159165.
4. Draaisma WA Controversies in paraesophageal hernia repair. A review of literature / Draaisma WA, Gooszen HG, Tournoij E. [et al.] // Surgical endoscopy. - 2005. - Vol. 19. - P. 13001308.
5. Frantzides CT Hiatal hernia repair with mesh: a survey of SAGES members / Frantzides CT, Carlson MA, Loizides S. [et al.] // Surgical endoscopy. - 2010. - Vol. 24. - P. 10171024.
6. Frantzides С.T. A prospective, randomized trial of laparoscopic polytetrafluoroethylene (PTFE) patch repair vs simple cruroplasty for large hiatal hernia / Frantzides С.T., Madan AK, Carlson MA [et al.] // Archives of surgery. - 2002. - Vol. 137. - P. 649 652.
7. Granderath FA Prosthetic closure of the esophageal hiatus in large hiatal hernia repair and laparoscopic antireux surgery / Granderath FA, Carlson MA, Champion JK [et al.] // Surgical endoscopy. - 2006. - Vol. 20. - P. 367 379.
8. Granderath FA Dysphagia after laparoscopic antireflux surgery: a problem of hiatal closure more than a problem of the wrap / Granderath FA, Schweiger UM, Kamolz T. [et al.] // Surgical endoscopy. - 2005. - Vol. 19. - P. 14391446.
9. Granderath FA Laparoscopic Nissen fundoplication with prosthetic hiatal closure reduces postoperative intrathoracic wrap herniation: preliminary results of a prospective randomized functional and clinical study / Granderath FA, Schweiger UM, Kamolz T. [et al.] // Archives of surgery. - 2005. - Vol. 140. - P. 4048.
10. Granderath FA Laparoscopic antireux surgery: Tailoring the hiatal closure to the size of hiatal surface area / Granderath FA, Schweiger UM, Pointner R. // Surgical endoscopy. - 2007. - Vol. 21. - P. 542 548.
11. Johnson JM Laparoscopic mesh hiatoplasty for paraesophageal hernias and fundoplications. A critical analysis of available literature / Johnson JM, Carbonell AM, Carmody BJ [et al.] // Surgical endoscopy. - 2006. - Vol. 20. - P. 362 366.
12. Oelschlager BK Biologic prosthesis to prevent recurrence after laparoscopic paraesophageal hernia repair: longterm followup from a multicenter, prospective, randomized trial / Oelschlager BK, Pellegrini CA, Hunter JG [et al.] // Journal of American college of surgeons. - 2011. - Vol. 4. - P. +461468.
13. Rathore MA Metaanalysis of recurrence after laparoscopic repair of paraesophageal hernia / Rathore MA, Andrabi SI, Bhatti MI [et al.] // Journal of society of laparoendoscopic surgeons. - 2007. - Vol. 11. - P. 456 460.
14. Targarona EM Mesh in the hiatus: a controversial issue / Targarona EM, Bendahan G., Balague C. [et al.] // Archives of surgery. - 2004. - Vol. 139. - P. 12861296.

