Установка «cryoWriter» був розроблений (зображені на рис. 2) для того щоб випробувати мініатюрних ет сітки підготовки процедури, пропоновані в Малюнок 1 C, D. Малюнок 2 A показує огляд різних компонентів, кріпиться до зворотна флуоресцентним мікроскопом. Культивування клітин модуль встановлений на лівій стороні мікроскопа; модуль для підготовки сітки EM розташований праворуч. Культивування клітин модуль (рис. 2 B) дозволяє зростання адерентних еукаріотичних клітин і клітин візуалізації клітинної культури в світловий мікроскоп. Окремі клітини лизировать комбінованою дією осмотическим шоком, електропорація і аспірації вмісту комірки в24, мікрокапілярного (рис. 2 Б, Малюнок 6 A) 25. Атмосферне lysate зразок потім може використовуватися для підготовки сітки для NS - або кріо EM. Крім того рішення запасів білка в ПЛР-пробірку може бути джерела вибірки. Мікрокапілярного (рис. 2 B) зайнятих підключений до системи насос високої точності, дозволяючи зразка томів буде придихом і обійтися з суб nL точністю. Як докладно йдеться в протоколи все зразка обробка виконується в межах цієї мікрокапілярного або на сітці EM без значних зразка транспорту. Наприклад ж мікрокапілярного використовується для лизируют окремих еукаріотів, аспіраційна lysate, стан його і нарешті звільнити аліквоти на ет сітки. Модуль підготовки Сітка складається з рухомих DP-стадії, що дозволяє температура ет сітки, розміщених на ньому, щоб бути точно контрольованою (рис. 2 C). NS-Теа підготовленого зразка сітки можна потім просто видалені зі стадії холодної і дозволило висохнути на повітрі при кімнатній температурі. Однак так званий кави кільце ефекти, які можна потім привести необхідно уникати кількісних Теа, де враховуються білка «частки». Щоб зробити це, сітки сушаться повільно на DP-сцені за допомогою поступово збільшуючи градієнт температури уповільнити випаровування рідини. Для кріо EM температура сітки тримається недалеко від точки роси; вибирається позитивний зсув приблизно 8 ° C, дозволяючи контрольованих випаровування рідкого зразка для тонкоплівкових стабілізації і витончення, який при необхідності може контролюватися датчіком26. Після обраного витончення час активується механізм підбору і зануритися і зразка є керамічні (рис. 2 C). Зверніть увагу, що цей занурюючись механізм не потрібен для NS-ет сітки, які зберігаються при кімнатній температурі.

Малюнок 2: огляд настройки cryoWriter. A) огляд cryoWriter установки монтується на зворотне світло мікроскоп (1). B) врізні області вказано на лівій стороні панелі A. клітин культивування відсіку (2), з мікрокапілярного (3) для маніпуляції і клітин лизис зразок позиціонується вище мініатюрних осередків на основі PDMS культури пластину (4). C) врізні області вказано на правій стороні панелі A. «забрати і падіння» механізму. Холі вуглецю фільм ет сітки (5) монтується між поради пінцет (6) і горизонтальному в безпосередньому контакті з контрольованою температурою стадії (7), називають етап точки роси (DP-етап) в основному тексті. Стадії температура строго контролюється через контролер PID і водяним охолодженням елемент Пельтьє, зберігаючи його мінімальної або близької до температури точки роси, в залежності від навколишнього середовища. DP-етап (7) встановлений на моторизованих xy осі для переміщення сітки по відношенню до мікрокапілярного. Мікрокапілярного, сам монтується на z сцені і можуть бути знижені до тих пір, поки це дуже близько до поверхні сітки EM і використані відмовитися від nanoliter розміру томів на підтримку зразка, покриваючи його (безперервної тонкої вуглецевого шару для NS-EM або Холі вуглецевої плівки для cr Ей Ем). Зверніть увагу, що рідина поглинання і дозування виконується за допомогою високоточної насос системи (8). Обійтися рідина може поширюватися шляхом переміщення сітки по відношенню до мікрокапілярного в спіралі. Для підготовки кріо EM забрати і падіння механізм заморожування (9) швидко передає зразок завантажені сітки в рідкий Етан (10) для швидкого охолодження і зразок вітрифікації. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.
Малюнок 3 показує представник результати, отримані для сіток NS-EM, підготовлений з використанням cryoWriter установки. Кінчик мікрокапілярного був завантажений з 5 nL зразка від Стоковий розчин і опущені в водосховище NS розчину (2% метиламіни вольфрамат) на кілька хвилин щоб дозволити диффузионное обмін іонів солі і NS (для теоретичної дискусії см. Арнольд, et Al. 24). Після цього, кондиціонованого зразка було обійтися на тонких вуглецевих фільм NS-ет сітки і сушать. Малюнок 3 A показує використання сітки слот таким же чином візуалізувати повний краплі, як це потрібно для кількісних Теа. Для того, щоб уникнути ефекту кільце кави, свіжу світіння виписаний сітки спочатку відбулася в температури точки роси (немає випаровування води) і потім повільно прогрівається на DP-сцені. Зверніть увагу, що для більшості додатків (наприклад, контроль якості зразка або структурний аналіз) цей процес повільного висихання не потрібно. Висока якість NS-препарати отримані без нього, як показано на малюнку 3 B, C. Раз приналежності для фосфат вільної низьким солі буферів знаходяться близько 3 хвилин, наприклад, з низьким вмістом солі трис буфері (рН 7,4 20 мм трис-HCl 50 мм NaCl), як показано на малюнку 3 B за допомогою вірус мозаїки тютюну (ПДЦ) як зразок. Малюнок 3 C являє найгірший сценарій як TMV в PBS буфера (2,7 мм KCl, 1,5 мм х2PO4, 136.9 мм NaCl, 8,9 мм Na2HPO4 · 7H2O, рН 7,4). Фосфат іони формують перехідних кристали з іонами важких металів NS (див. Рис. 5 C), подовження приналежності термінів (7 хв). Інші солі важких металів може також використовуватися з модуль підготовки сітки, наприклад, 2% метиламіни ванадату або амонію молібдату (див. Також Арнольд, і ін. 24). Однак уранила ацетату не підходить; зшивання ефект це пляма призводить до агрегатів, якщо зразок протеїну пов'язано в розчині, перш ніж фільм адсорбція вуглецю (див. Малюнок 5 E) 23.

Малюнок 3: типові результати для сіток NS, підготовлений з використанням cryoWriter установки, як зазначено на малюнку 1 C. A) огляд зображення 3 краплі nL обійтися на сітці слот після кондиціонування з метиламіном вольфрамат 2%. B) TMV в буфер TRIS 20 мм. Врізні показує 3 x розширення зазначеного регіону. Адаптовано з Арнольд, et al.24 (додаткові дозволи, які стосуються витримки матеріалу повинні бути спрямовані в ACS). C) вірус мозаїки тютюну (ПДЦ) в буфері PBS. Врізні показує 3 x розширення зазначеного регіону. Адаптовано з Арнольд, et al.24 (додаткові дозволи, які стосуються витримки матеріалу повинні бути спрямовані в ACS). Масштаб бари: A, 100 мкм; B, 50 Нм; C, 80 Нм. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.
На малюнку 4 зображено типові результати, отримані для сіток кріо EM, підготовлений з використанням cryoWriter установки. Група 4A показує сітку Атлас покритих керамічною зразка. 4б група показує однорідності склоподібним льодом в обраній сітки слот. В обох випадках зразок був в 25 мм HEPES-Кох pH 7.5, 50 мм NaCl буфер, що містить 0,05% Fos 14 миючого засобу. Багато зразків і буфери були протестовані і порівнянних високу якість склоподібного тіла льоду було отримано, але необхідні умови буфер залежних (див. Також обговорення рис. 5). Група 4C показує apoferritin частинок і бактеріофага в Tris-HCl буфері (20 мм трис-HCl, 50 мм NaCl, рН 7,4), що відображається на високій defocus для збільшення контрастності. Група 4D показує 200 кДа мембранний білок, стабілізований amphipoles.

Малюнок 4: типові результати для сіток кріо EM, підготовлений з використанням cryoWriter установки, як зазначено на рис. 1 D. Зразки і буфери розрізняються в прикладах. Всі зразки були завантажені на Холі вуглецевих плівок. A) колаж зображень ( «Атлас сітки») Огляд зразка, що містить 150 кДа мембранний білок, периферії склоподібним льодом позначається білими стрілками. B) розширене сітки слот з сітки, приготовані той же буфер, показані Холі вуглецевої плівки зі склоподібним льодом. Деякі отвору не заповнені з буфером вибірки як позначається білими стрілками. C) вуглецю отвір з керамічні зразки, що містять apoferritin білкових комплексів і бактеріофагів. Вставка: подвійна розширення показані хвіст бактеріофага. Біла зірочка вказує вуглецевої плівки. Зверніть увагу, що образ був записаний з високим defocus для збільшення контрастності. D) 200 кДа мембранних білків відтворена в amphipols. Вставка: 2 x розширення зазначеного регіону, показано з підвищеною контрастністю. Масштаб бари: A, 100 мкм; B, 10 мкм; C і D, 80 Нм. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.
Установка cryoWriter дозволяє систематичного відбору для оптимальних умов приготування Ем сітки; Приклад показаний на рис. 5 A (apoferritin в 25 мм HEPES-Кох pH 7.5, 50 мм NaCl, 0,05% Fos 14). В цьому експерименті, склоподібним льодом, «витончення» температура була різною, але витончення час (наприклад, розрив у часі між зразка додатка і невеликим заморожування) зберігалася (1 s). При низьких температурах зміщення (наприклад, 8 K) шар зразок був занадто товста. При більш високих температурах зміщення, склоподібним льодом в отвори була тонше (10 K, 12 K), до тих пір, поки на певному етапі (вище 18 K) сітці стала повністю сухий (не показано). В результати представлені тут, зміщення 12 K призводять до великої однорідної області склоподібним льодом як зазначено чорними стрілками. Такі експерименти оптимізації можуть бути виконані з буфером цільової вибірки з використанням «тест» білків (наприклад, apoferritin). Знайти кращі умови застосовуються до цільової вибірки. Крім того сітки з параметрами далека від оптимальної часто може бути визнано під час процедури підготовки і не потрібно буде показаний в електронний мікроскоп, економлячи значний час. Малюнок 5 також показує галерею типових кріо Ем (Група B) і артефакти NS-Ем (панелей CE) для установки cryoWriter. Кріо ет сітки, показані на панелі 5B з TMV в PBS, що містять 0,1% децил β-D-maltopyranoside (2,7 мм KCl, 1,5 мм х2PO4, 136.9 мм NaCl, 8,9 мм Na2HPO4 · 7H2O, рН 7,4, 0.1% DM) був надмірно розбавляти. Фон зображення зернистим, тому що концентрація солі стали занадто висока. Загалом зовнішній вигляд зразка, здається, не бути лінійна функція концентрації солі; зерна раптом стали видні коли Порогова концентрація досягається в процесі проріджування. Зверніть увагу, що небажані речовини можуть бути видалені за належністю крок до підготовки сітки, як описано для NS-ет в протоколі розділ 1.6. NS може викликати інші артефакти. У прикладі, показаному в панелі 5C PBS буфера (2,7 мм KCl, 1,5 мм х2PO4, 136.9 мм NaCl, 8,9 мм Na2HPO4 · 7H2O, рН 7,4) без зразка було обумовлено в 2% метиламіни вольфрамат за 3 хв преципітати і кристали очевидним і надають великі сили на поверхні вуглецю призводить до тріщин. Єдина форма преципітати в певній концентрації PBS і NS діапазон і можна уникнути шляхом кондиціонування зразка для довше (Порівняйте рис. 3 C). Група 5D показує на периферії обійтися краплі зразка NS виставці «кава кільце». Це буде заважати аналізу кількісних, Загальна проб і можна уникнути шляхом уповільнення процесу сушіння, тобто , Тримати ет сітки при температурі точки роси під час зразка додатка, а потім поступово збільшуючи температуру сушити) см. Рис. 3 А). Група 5E (apoferritin в 20 мм HEPES, pH 7.0, кондиціонером 3 хв) показує активність зшивання уранила 2% ацетат пляма, яка не може використовуватися для зразки протеїну стан, перш ніж вони адсорбуються до вуглецю фільм підтримує.
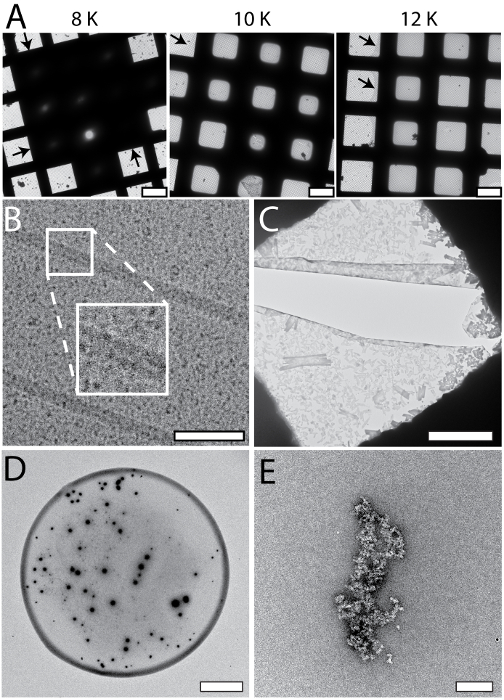
Малюнок 5: систематичні зміни і артефакти спостерігається, коли установка cryoWriter був використаний для підготовки сітки для NS - і кріо EM. A) зміни товщини систематичного склоподібним льодом; Оптимізація підготовки сітки для кріо EM. Зміщення температури DP-етапу був різноманітний (8 K 12 K) зберігаючи витончення постійна часу (1 s). Стрілки вказують на периферії зразок шару. B) сіль ефекти; занадто високо концентрований, тобто, витончення крок був занадто довго. Врізні зображує 2 x розширення зазначеного регіону. C) сіль преципітати, утворений PBS буфера присутності солі важких металів. Зразки, що містять PBS буфера повинні витримуватися більше, ніж приклади в інших буферів. Тут PBS буфера без зразка було обумовлено в 2% метиламіни вольфрамат 3 хв, типове час для інших зразків буферів. Зверніть увагу на тріщини в фільмі вуглецю найбільш ймовірно через сильний взаємодії від опадів, діючи на тонкій підтримку під час процесу сушіння. D) «Кава кільце» ефект. E) Apoferritin кондиціонерами в 2% уранила ацетат за 3 хв уранила іонів демонструють значні зшивання активності і apoferritin кластери форми великих агрегатів. Масштаб бари: A, 80 мкм; B, C 80 Нм, 12 мкм; D, 80 мкм; E, 200 Нм. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.
Невелика кількість і обсяг, необхідний для ет сітки підготовки з використанням cryoWriter установки дозволяє нові типи експериментів. Наприклад загальний вміст одного осередку можна зібрані і підготовлені для NS - і кріо EM. У малюнку 6 A вказується процедура. Прихильником, еукаріотів (ГЕС 293) лизировать одночасних електропорації і зразок аспірації (Група 6A) 25. Сумарний обсяг 3 придихом nL, який містить lysate клітини і зберігається в мікрокапілярного для подальшої обробки. Для NS-EM, показаний в панелі 6B засіб культивування клітин обмінювався з PBS буфера (2,7 мм KCl, 1,5 мм х2PO4, 136.9 мм NaCl, 8,9 мм Na2HPO4 · 7H2O, рН 7,4) до лізис клітин. Вміст комірки були наддуву в 3 nL буфера і кондиціонерами в водосховище NS, як зазначено в Малюнок 1 C на 10 хв, потім, тому 5 nL було обійтися на безперервній вуглецевої плівки NS-ет сітки. Індивідуальних білків, наприклад, нитчасті актину і мембрани патчі з доданою білків може бути визнано в зображенні. Для кріо EM, показано на малюнку 6 C, обсяг 3 nL було обійтися на Холі вуглецю ет сітки без повторного аспірації для видалення рідини. Щодо товсті фільм зразка формується був широко розбавляти до вітрифікації. Щоб зробити це, DP-стадії температура була поступово збільшується, починаючи з температури точки роси. Витончення процес контролюється датчиком система реального часу до попередньо заданого порогу спрацьовування механізму «забрати і падіння» і зразок стеклования (для отримання детальнішої інформації див. Арнольд, et al. 26). мембранних структур і білки можуть бути визнані в зображенні.
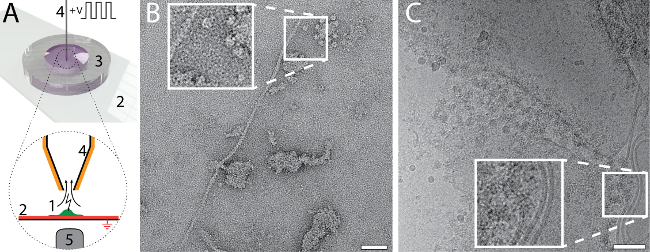
Малюнок 6: єдиний візуальний протеоміки клітин з використанням cryoWriter установки. A) лізис однієї адерентних еукаріотичної клітини. Клітка вирощується на функціоналізованих, скляне ковзання Іто покриттям (червоний) (2) в мініатюрних Петрі (3) 25 (1, зелений). Іто шар заземлені. Осередок підійшла мікрокапілярного (4), який з платиновим покриттям. Початковий шок осмотичного (не вказано) надається для полегшення лізису, яка виконується ряд електричних імпульсів і перерізують сил під час прагнення lysate клітини. Цей процес можна контролювати за допомогою світлової мікроскопії; об'єктива мікроскопа є зазначено (5). У розділі наші попередні работи24,25. B) NS-EM образ lysate від окремого осередку 293 ГЕС. Нитчасті актину і мембрани патчі з доданою білки є видимими. Група, адаптований Арнольд, et al.24 (додаткові дозволи, які стосуються витримки матеріалу повинні бути спрямовані в ACS). C) кріо-EM образ lysate від окремого осередку 293 ГЕС. Врізні показує 2 x розширення зазначеного регіону, де видно типові мембранних структур з пов'язаних білків. Група C адаптовано з Арнольд, et al. 26 барів масштабу: B, 50 Нм; C, 80 Нм. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.

