- трохи статістіккі
- Механізми резистентності стафілококів щодо bлактамних антибіотиків [2]
- Лабораторна діагностика резистентності стафілококів до bлактамним антибіотиків
- поширення MRSA
- Госпітальний MRSA (HAMRSA)
- Амбулаторний (позалікарняних) MRSA (CAMRSA)
- Обговорення
Staphylococcus aureus (золотистий стафілокок) - перший з мікроорганізмів, у якого була виявлена стійкість до раніше безвідмовно чинним антибіотиків. З нього почалася історія вивчення пеніцилінази - першої в ряду bлактамаз і т.д. і т.п. Стійкість до метициліну (або оксациллину, що в даному випадку одне і те ж), сполучена зі стійкістю до інших bлактамним антибіотиків, дала назву на мультирезистентний стафілококів. Вперше про метіціллінрезістентних стафілококу (MRSA) заговорили більше 50 років тому під час клінічних випробувань метициллина в Англії. З тих пір у світовій науковій літературі, присвяченій антибіотиків, немає більш часто зустрічається абревіатури, ніж MRSA - methicillinresistant Staphylococcus aureus. Названий «чумою ХХ століття» ще в доСПІДовскіе часи, золотистий стафілокок продовжує очолювати список проблемних мікроорганізмів. У команді «поганих хлопців» ESKAPE (див. «Хвороби і антибіотики» № 2 за 2011 р) йому належить буква S.
трохи статістіккі
MRSA - найбільш часто зустрічається мультирезистентний збудник внутрішньолікарняних інфекцій в Європі. Згідно з даними Європейського центру по контролю за інфекціями (ЕСDС), 170 000 MRSAінфекцій в рік, з яких близько 5 тисяч закінчуються летально, обумовлюють більш 1 мільйона додаткових койкодней і обходяться європейській системі охорони здоров'я в суму близько 380 мільйонів євро [1].
На тлі такої значної статистики здається майже неймовірним повна відсутність даних про поширеність цього збудника в лікарнях пострадянського простору. Кожен грамотний читач, звичайно, розуміє, що причина цього лежить не в досконало лікарняної гігієни, а у відсутності адекватної лабораторної діагностики клінічних інфекцій. При уявній простоті лабораторного підтвердження метицилінорезистентності ( «поставити диск з оксациллином») коректна антибіотикограмою вимагає суворого дотримання стандартів і в багатьох випадках потребує проведення підтверджуючих тестів. Тому я почну з опису механізмів множинної антибіотикорезистентності і стандартних методик її визначення у стафілококів.
Механізми резистентності стафілококів щодо bлактамних антибіотиків [2]
Розрізняють два основних типи резистентних стафілококів і відповідних механізмів.
Стафілококи, резистентні до пеніциліну, складають майже 80% клінічно значущих ізолятів. Цей тип резистентності обумовлений виробленням пеніцилінази, яка руйнує аміно і уреїдопеніциліни, але не діє на напівсинтетичні пеніциліни (метицилін і оксацилін), а також на цефалоспорини та карбапенеми. Синтез пеніцилінази індукується bлактамнимі антибіотиками.
Стафілококи, резистентні до метициліну (S.aureus і 60-80% коагулазонегатівних стафілококів). Як відомо, bлактамние антибіотики є субстратною аналогами і ковалентних серінактівному центру пеніцилінзв'язуючих (або шунтуючих) білків (ПСБ), які необхідні для побудови клітинної стінки стафілокока. Зв'язок ПСБ з bлактамамі необоротна і призводить до загибелі стафілококів. Розрізняють принаймні 5 різних ПСБ, з яких ПСБ2а володіє майже в тисячу разів меншим аффинитетом до bлактамам і тому здатний витримати атаку антибіотиків. Цим пояснюється перехресна резистентість метицилінстійкі стафілококів до всіх bлактамним антибіотиків. ПСБ кодуються хромосомними генами, серед яких ген mecA відповідає за синтез ПСБ2а. Цей ген присутній тільки у метіціллінрезістентних стафілококів (як у S.aureus, так і у коагулазонегатівних). Однак фенотипическая експресія гена mecA дуже варіабельна і залежить від багатьох факторів, наприклад від живильного середовища, температури і т.д. За величиною мінімальної переважної концентрації (МПК) розрізняють штами з гомогенним (МПК> 50 мг / мл) і гетерогенним (МПК> 2 мг / мл) типом експресії mecA. У гетерогенних штамів резистентної може бути тільки одна з 108 клітин. Крім того, у погранічнорезістентних до оксациллину штамів (≥ 2 мг / мл) можливі інші механізми. Зустрічаються штами (наприклад, клон ST25), які, завдяки гіперпродукції bлактамаз, частково втрачають чутливість до оксациліну (так звані BORSA - borderlineoxacillinresistent S.aureus - погранічнорезістентние штами). Описано також штами S.aureus з модифікованими ПСБ (MODSA). У обох варіантів «помилкових» MRSA відсутня ген mecA і, відповідно, ПСБ2а. BORSA і MODSA зустрічаються досить рідко, але обумовлюють необхідність MRSAподтверждающіх тестів при виявленні фенотипической резистентності до оксациллину звичайними методами (диски або МПК). Помилкові оксацилінорезистентними штами зазвичай чутливі до цефокситину. Таким чином, фенотипическое визначення стійкості або чутливості до цефокситину (дифузія в агарі або МПК) може служити додатковим підтвердженням статусу MRSA.
Лабораторна діагностика резистентності стафілококів до bлактамним антибіотиків
Для того щоб зробити висновок про ефективність численних груп та цефалоспоринів, досить тестувати всього 2, в крайньому випадку 3 антибіотика, а саме пеніцилін, оксацилін і / або цефокситин.
Шановні клініцисти! Не спокушайтеся довгим списком тестованих антибіотиків в лабораторному аналізі. Поруч досліджень доведено невідповідність між результатом лабораторного тестування та клінічною ефективністю антибіотиків. Якщо стафілокок, згідно антибиотикограмме, стійкий до оксациллину, призначення будь-яких цефалоспоринів (за винятком нових MRSAустойчівих, наприклад цефтобіпрол) свідомо виключено, незалежно від того, як виявив себе штам при тестуванні in vitro. Саме тому статус «оксацилінорезистентними» потребує підтвердження іншими, більш об'єктивними, ніж зона пригнічення росту в міліметрах, методами.
Критерії резистентності стафілококів до пеніциліну і оксациллину згідно з нормами американського інституту клінічних та лабораторних стандартів (CLSI) [3] наведені в табл. 1.

Як було сказано, чутливість до пеніциліну у стафілококів зустрічається рідше, ніж стійкість (більше 80%). Проте пеніцилін G в зв'язку з високою ефективністю для чутливих штамів залишається препаратом вибору. Тому в разі виявлення алергії на пеніцилін або одним з рутинних фенотипических методів необхідно переконатися в тому, що штам не має прихованих можливостей протистояти антибіотикам in vivo за рахунок синтезу пеніцилінази. Пеніциліназа стафілококів індукується bлактамнимі антибіотиками, тому в тесті використовують культуру після контакту з bлактамамі, наприклад з прикордонної зони навколо диска з оксациллином на чашці або з бульонной суспензії в субінгібіторной концентрації при визначенні МПК.
Підтвердження резистентності до оксациллину, виявленої одним з рутинних методів, є обов'язковою умовою присвоєння штаму статусу MRSA. Золотим стандартом підтвердження MRSA є генотипический аналіз штаму на наявність гена mecA. Розроблена для цього полімеразна ланцюгова реакція (ПЛР) стає все більш доступною для добре обладнаних клінічних лабораторій. Гідною альтернативою генетичного аналізу є простою і малотрудоемкие серологічний тест на наявність ПСБ2а (наприклад, від фірми BioMerieux). При проведенні скринінгу на MRSA в лікарнях Німеччини широко застосовуються індикаторні поживні середовища, на яких MRSA виростає у вигляді пігментованих колоній. Серологічний тест на ПСБ2а в підозрілих колоніях підтверджує MRSA без проведення класичної антибіотикограми.
Спектр резистентності більшості внутрішньолікарняних MRSAштаммов не обмежується тільки bлактамамі, але поширюється і на інші групи антибіотиків. Тому розгорнута антибіотикограмою, що включає основних представників інших груп, крім bлактамов, має важливе значення в пошуках препарату вибору.
Внутрішньовидової типування мультирезистентного Staphylococcus aureus
Підтвердженням статусу MRSA і визначенням фенотипической антибіотикорезистентності для виділеного від хворого ізоляту вичерпується компетенція рутинної клінічної лабораторії. Якщо питання стоїть про епідеміологічний аналіз внутрішньолікарняних інфекцій, наприклад про знаходження джерела інфекції або шляхи передачі, в силу вступають генетичні методи внутрішньовидової типування, які проводять референтних лабораторій і дослідницькі групи. У далекому минулому залишилося фаготіпірованіе стафілокока. Сучасні методи внутрішньовидової диференціації штамів Staphylococcus aureus засновані на секвенсаналізе одного (singlelocus) або декількох (multilocus) ділянок гена стафилококкового протеїну А. SPAтіпірованіе, засноване на секвенцірованіі єдиного поліморфного ділянки X стафилококкового протеїну А все активніше заміщає метод мультілокусного секвенцірованія (MLST), що вважався до недавнього часу золотим стандартом визначення клональних ліній (секвенцтіпов: ST) і клональних комплексів (CC) S.aureus. Розгалужена мережа дослідних лабораторій, що займаються питаннями поширення різних штамів MRSA в усьому світі, потребує спільних стандартних епідеміологічних мітках. SPAтіпірованіе знаходить в зв'язку з цим все більше прихильників, тому що підходить для аналізу як локального (в межах однієї лікарні), так і глобального поширення стафілокока [4].
поширення MRSA
Географічне поширення MRSA в країнах Європи можна оцінити, грунтуючись на даних Європейської мережі нагляду за антибіотикорезистентністю (EARSNet: www.ecdc.europa.eu/en/activities/surveillance/EARSNet), яка реєструє питома вага оксацилінорезистентними серед усіх штамів S.aureus, виділених з культури крові. Протягом багатьох років питома вага MRSA на півдні Європи (Португалія, Греція, Іспанія, Італія) досягає 50% і більше. Скандинавські країни демонструють традиційно низький рівень MRSA. Між 10 і 25% знаходиться питома вага полірезістеного S.aureus в Центральній Європі і Великобританії (рис. 1). У Німеччині після стрибка в 90-х рр. протягом багатьох років цей показник стабільно знаходиться на рівні 19-25%.

Слід нагадати, що відсотковий показник служить лише для приблизної оцінки ситуації в окремих країнах і регіонах, але ні в якій мірі не дає уявлення про справжню поширеності MRSA в лікарнях. Набагато більше інформації для об'єктивного аналізу і планування профілактичних заходів дає система нагляду за внутрішньолікарняними інфекціями KISS (Krankenhaus InfektionsSurveillance Systems:) *. Згідно KISSMRSA (www.nrzhygiene.de) в лікарнях Німеччини щорічно реєструється 132 000 випадків інфекцій і колонізації (безсимптомне носійство) метіціллінрезістентним стафілококом. За даними реєстрації в 199 лікарнях, які беруть участь (добровільно!) В системі інфекційного нагляду, поширеність MRSAобсемененності (інфекція і колонізація) склала в 2009 році 1,14 / 1000 койкодней. При цьому більшість пацієнтів (79,5%) мали MRSA вже під час вступу до лікарні і лише 20,5% придбали мультирезистентний збудник в лікарні (нозокоміальна інфекція). Мікробіологічний скринінг на MRSA при надходженні до лікарні або іншої установи тривалого перебування пацієнтів (наприклад, будинок для людей похилого віку, реабілітаційна клініка і т.п.) є важливою умовою для диференціації істинно нозокоміальних інфекцій і занесених ззовні. За результатами досліджень, проведених в Німеччині в 2000х роках, MRSA знаходять у 1-5% обстежених при надходженні до стаціонару або будинок престарілих. Дані попереднього скринінгу служать раціональному плануванню профілактичних і протиепідемічних заходів щодо носія MRSA і / або пацієнта з групи ризику.
До кінця 90-х років MRSA був виключно внутрішньолікарняної проблемою. У наступні десятиліття, завдяки впровадженню програм інфекційного контролю в лікарнях і будинках престарілих, рівень захворюваності внутрішньолікарняної MRSAінфекціей (HAMRSA - health care associated MRSA) істотно знизився. У той же час були виявлені інші, позалікарняних резервуари MRSA, які підтримують циркуляцію мультирезистентного збудника і важче піддаються контролю. Йдеться про внебольничном MRSA (CAMRSA - communityassociated MRSA), про який заговорили на початку 2000х років, і стафілококу зоонозного походження (LAMRSA - livestock associated MRSA), який опинився в центрі уваги всього кілька років тому. У табл. 2 представлена характеристика цих трьох різних субтипов MRSA.
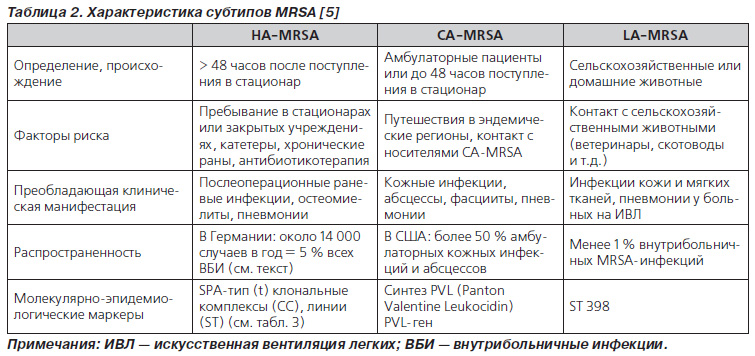
Тепер докладніше про кожен з субтипов.
Госпітальний MRSA (HAMRSA)
Лікарні, інтернати та будинки пристарілих, реабілітаційні установи з тривалим перебуванням пацієнтів протягом декількох десятиліть є класичним місцем циркуляції MRSA. Особливу настороженість в плані виникнення HAMRSAінфекціі повинні викликати такі пацієнти (фактори ризику):
- хворі з відомим MRSAанамнезом;
- хворі з регіонів / установ з високим рівнем народження MRSA;
- хворі, котрі пробули в стаціонарі не менше 3 днів протягом останніх 12 місяців;
- хворі, які мають професійний контакт з сільськогосподарськими тваринами (особливо свинями);
- хворі, що мали під час стаціонарного перебування контакт з носієм MRSA (наприклад, загальна палата);
- хворі з двома і більше з нижченаведених факторів ризику:
- потребують постояном догляді;
- антибіотикотерапія в останні 6 місяців;
- катетер (наприклад, сечового міхура);
- хронічний діаліз;
- хронічні рани, виразки, інфекції м'яких тканин;
- опіки.
Питома вага MRSA серед усіх S.aureus ізолятів від стаціонарних пацієнтів в Німеччині виріс з 1,1% в 1990 році до 17,5% в 2001 р У 2011 році, за даними Інституту Роберта Коха (Robert Koch Institut - RKI), цей показник склав 23,4% (RKI: https://ars.rki.de станом на 25.09.2012). Однак в стаціонарах інтенсивної терапії реєструється підвищений питома вага MRSA (> 37%) [6]. Визначити показники захворюваності MRSAінфекціямі в стаціонарах інтенсивної терапії в Німеччині дозволяє введена в 2009 році обов'язкова федеральна реєстрація виявлення MRSA в культурі крові і спинномозкової рідини. Станом на грудень 2010 року в Німеччині було зареєстровано понад 3000 випадків MRSAбактеріемій, що відповідає захворюваності 1,94 на 100 000 населення (RKI: www.3.rki.de/SurvStat). Для порівняння, поширеність госпітальних бактериемий в Англії і США в 2006-2007 роках становила 7,2-7,8 на 100 000 населення [7].
У табл. 3 представлені найбільш поширені епідемічні штами MRSA, названі за місцем першого виділення, з профілем антибіотикорезистентності, згруповані за трьома молекулярногенетіческіх групам маркерів - клональний комплексам (СС), клональний лініях (ST) і SPAтіпу (t).

Спостереження за циркуляцією різних клональних ліній MRSA протягом останніх 10 років демонструє динамічність популяції збудника в часі і просторі. Так, наприклад, MRSA ST 239 (Віденський епідемічний штам), який вважається найбільш зустрічається клональной лінією в світі, до кінця 1990-х років був широко поширений в Австрії та Чехії, в даний час домінує в Південній Європі (Туреччина) і Росії, але майже відсутня в Німеччині. Епідемічний штам EMRSA16, CC 30 зустрічається тільки у Великобританії, де є другим по частоті штамом MRSA. У лікарнях Німеччини в 2010 році найбільш часто виявлялися домінуючі протягом багатьох років штами Барнім (ST 22) - 76% і Рейнгессен (ST 255) - 59%.
З табл. 3 слід також, що резистентність MRSAштаммов не обмежується тільки bлактамамі. За даними RKI, спостерігається чітка тенденція у розвитку супутньої резистентності у госпітальних MRSAштаммов в Німеччині, а саме до 2010 року:
- 90% усіх НАMRSA були резистентні до ципрофлоксацину;
- 88% - резистентні до моксифлоксацину;
- більше 50% штамів резистентні до еритроміцину і кліндаміцину;
- до найважливішого препарату вибору, рифампіцину, резистентність зустрічалася у менше 1% штамів;
- близько 5% НАMRSA штамів резистентні до мупіроцин і гентаміцину (препаратів, що використовується у вигляді мазей для санування носіїв).
На діаграмах представлені дані німецького національного референтного центру з вивчення стафілококів при RKI, що демонструють частоту виділення MRSA в стаціонарах різного профілю (рис. 2) і при різній патології (рис. 3).
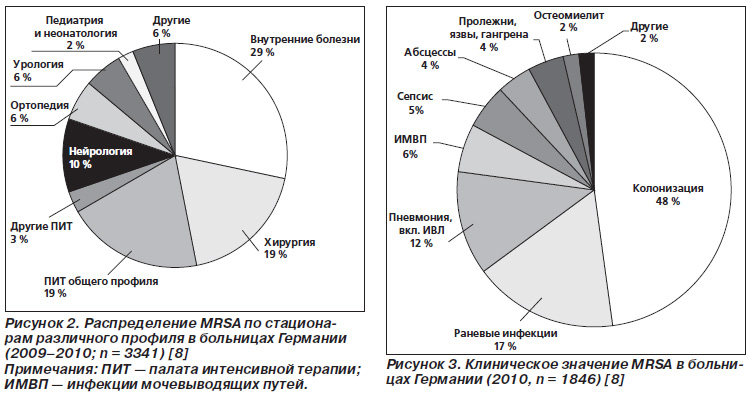
Згідно з першою діаграмі (рис. 2), MRSA найчастіше виділяється в соматичних стаціонарах (29%), за ними слідують хірургічні стаціонари і палати інтенсивної терапії загального профілю (по 19%).
За другою діаграмі (рис. 3) можна оцініті Клінічне значення MRSA, зокрема, почти половина (48%) віділеніх штамів НЕ є патогенами, а лишь Присутні в організмі хворого (колонізація). Цей факт можна Віднести на рахунок частоти и пріводів мікробіологічного обстеження пацієнтів німецькіх Лікарень, что Включає аналіз при надходженні до стаціонару и обстеження контактних осіб. Найбільш часта патологія, яка викликається MRSA в стаціонарах, це ранові інфекції (17%), на другому місці за частотою виділення MRSA знаходяться пневмонії, включаючи пацієнтів зі штучною вентиляцією легень (ШВЛ) - 12%. Звертає на себе увагу зросла частота MRSAінфекцій сечовивідних шляхів (ІСШ 6%), яка останнім часом випередила такі типові для MRSA інфекції, як сепсис (5%), абсцеси (4%) і т.д. Відповідно, до 6% зросла питома вага урологічних стаціонарів, які реєструють MRSAінфекцію (рис. 2).
Слід зазначити, що характеристика госпітальних MRSAштаммов в Німеччині не може безпосередньо інтерпольованого на ситуацію в інших країнах і регіонах.
Стандартизація методів і постійний обмін інформацією в мережі лабораторій і дослідницьких колективів, які займаються вивченням молекулярної епідеміології MRSAштаммов, дозволяє простежити шляхи циркуляції і оцінити глобальне поширення мультирезистентного збудника в лікарнях.
Амбулаторний (позалікарняних) MRSA (CAMRSA)
CAMRSAінфекцію слід припускати у амбулаторних пацієнтів або якщо вона виникає не пізніше 72 годин перебування в стаціонарі при відсутності у госпіталізованого перерахованих вище факторів ризику. Найчастіше мають значення несприятливі санітарно-гігієнічних умови, тісний контакт з носіями САMRSA (в родині, школі, сауні, спортклубі, гомосексуальні контакти і т.д.), а також перебування в ендемічних районах [9]. Найважливішим фенотипическим диференціальним ознакою САMRSA штамів є вироблення PVLтоксіна (PantonValentine Leukocidin), що дозволяє в більшості випадків з'ясувати справжнє походження MRSA. PVLтоксін, володіючи цитотоксическим ефектом щодо нейтрофілів, надає САMRSAштаммам підвищену вірулентність [10]. Найбільш типова клінічна картина - це глибоко проникають інфекції шкіри і м'яких тканин (абсцеси, фурункули і карбункули). Однак описані важкі САMRSAінфекціі (наприклад, фасцііта, міозити, пневмонії), що протікають дуже гостро і з високою летальністю (більше 30%).
САMRSA з'явився спочатку в Східній Азії і Каліфорнії, а потім поширився по всьому світу. Особливо багато випадків описано в США, де CAMRSA - найбільш частий збудник (більше 50%) амбулаторних інфекцій шкіри і м'яких тканин (перш за все абсцесів) і домінує серед всіх MRSAінфекцій [11]. Для Європи ендемічним осередком САMRSA є середземноморські країни, особливо Греція, Туреччина, Італія [12]. Поїздки в Східну Азію, Океанію, Африку і на Близький Схід також пов'язані з занесенням САMRSA в Європу [13]. Подальше поширення стафілокока відбувається при щоденно співпрацюють в колі сім'ї, де носіями стають 43-47% контактних з індекспаціентом (тобто носієм САMRSA) осіб [14].
За допомогою молекулярногенетіческіх типування були встановлені дві донімірующіе в лікарнях США клональні лінії САMRSA, а саме USA 300 / ST8 і USA 400 / ST1, які виробляють токсин PVL. У Німеччині на відміну від США популяція САMRSA штамів нечисленна і гетерогенна. У 90х роках питома вага штамів MRSA, несучих ген PVL, серед інших ізолятів S.aureus в лікарнях Німеччини склав 0,9% від усіх культур крові і 1,4% від усіх мазків з носа [15]. З 248 амбулаторних пацієнтів з шкірними інфекціями тільки у 1,6% був знайдений PVLMRSA, хоча серед всіх метіціллінрезістентних Staphylococcus aureus питома вага цього типу збудника досяг 22% [16].
У популяції САMRSA в Німеччині домінують два штами [8]:
- «американський» USA 300 / ST8, резистентний до еритроміцину, ципрофлоксацину (60%) і моксифлоксацину (50%);
- штам клональной лінії ST 80, резистентний до фузидинову кислоті і окситетрацикліну.
До антибіотиків системного застосування, добре проникає в шкіру і м'які тканини, таким як рифампіцин, котримоксазол або лінезолід, а також до мупіроцин штами САMRSA зберігають високу чутливість.
Стафілокок зоонозного походження (LAMRSA)
Метицилінрезистентний стафілокок виділений у різних видів сільськогосподарських тварин. Встановлено, що в Німеччині LAстафілококком уражено від 43 до 70% всіх свинарських ферм [17]. Молекулярне типування стафілококів від сільськогосподарських тварин показало, що більшість (у свиней більше 90%) ізолятів MRSA належать до одного клональний комплексу СС 398. Це дозволяє диференціювати LAMRSA від госпітальних і амбулаторних штамів MRSA. Крім свиней, LAMRSA знаходять у корів, курей та індиків, а також у коней і домашніх тварин (собак, кішок, голубів і морських свинок) [18]. Найчастіше LAMRSAінфекція протікає безсимптомно, проте описані спалахи різних стафілококових запальних захворювань у корів і коней [19].
LAMRSA клональной лінії СС 398 здатний передаватися від тварин людині. Так, було показано, що в Німеччині у 86% свинарів носова порожнина заселена LAMRSA. Ветеринари та члени сімей свинарів, які не мають регулярних контактів з тваринами, також є носіями LAMRSA відповідно в 12-45 і 4% випадків [20]. У регіонах з високою щільністю тваринницьких ферм носійство LAMRSA у пацієнтів при надходженні в стаціонари становить 17% від всіх MRSA.
Згідно масштабному європейському молекулярноепідеміологіческому дослідженню [21] MRSAСС398 склав менше 1% ізолятів з культури крові. Таким чином, незважаючи на часте носійство і, як наслідок, занесення в лікарні, зоонозних стафілокок не належить до високоінвазівним патогенів. Однак поза лікарнями ST 398 є третім за частотою після ST 8 і ST 80 САMRSA збудником MRSAінфекцій шкіри і м'яких тканин [8]. При цьому у поодиноких штамів виявлено ген PVLтоксіна. Випадки харчових токсикоінфекцій, викликаних LAMRSA, незважаючи на значну забрудненість продуктів тваринного походження, не були зареєстровані.
Обговорення
Представлена читачеві проблема мультирезистентного стафілокока, зрозуміло, не вичерпується лабораторною діагностикою та молекулярної епідеміологією. Це всього лише способи визначення масштабів проблеми. Наступний етап - подолання проблеми, тобто Розробка та впровадження профілактичних і протиепідемічних заходів щодо боротьби з мультирезистентний збудником, перш за все в лікарнях. У цьому напрямку в Європі і в світі зроблено і робиться дуже багато: створюються державні програми, організовуються міжнародні мережі з обміну інформацією та нагляду (surveillance) за MRSA, не кажучи вже про постійне озвучуванні цієї проблеми на міжнародних конференціях всіх рівнів.
У мене була спокуса зробити короткий огляд всіх цих колосальних зусиль по боротьбі з MRSA, але потім постало питання: а чи буде це цікаво? Адже в лікарнях України, як і в інших «позаєвропейських» державах пострадянського простору, проблеми MRSA немає. Тобто, звичайно, на тлі широкого застосування антибіотиків (а саме це є доведеною причиною виникнення і поширення мультирезистентних збудників) MRSA, без сумніву, викликає ряд внутрішньолікарняних інфекцій. Але при безпорадності і необов'язковість клінічної мікробіологічної діагностики збудник інфекцій залишається невідомим, а грамотний (не в останню чергу завдяки журналу «Хвороби і антибіотики») лікар в більшості випадків досягає успіху за допомогою емпіричної антибіотикотерапії. Щасливчик! Він не знає, як багато мультирезистентних збудників циркулює в його лікарні. Він може призначити антибіотик без мікробіологічного аналізу, а якщо пацієнт готовий платити (а хвора людина завжди багатий), він отримає новітній антибіотик за останньою рекомендацією представника фармацевтичної компанії. Про таку свободу західний лікар може тільки мріяти. Там між лікарем і хворим стоять лікарняні каси, які платять за діагностику і лікування і ретельно контролюють, на якій підставі призначений той чи інший препарат. Звідси виникають багато етичні та організаційні проблеми, які лежать поза сферою моєї компетенції - клінічної мікробіології. Я припиняю «дозволені промови», але готова з радістю вислухати співрозмовника - мого читача. Після трьох статей з циклу «Бесіди з мікробіологом» хотілося б отримати feedback і дізнатися, хто він, мій співрозмовник? Наскільки корисною була викладена інформація? Які теми з клінічної мікробіології були б вам цікаві?
Залишаюся на зв'язку до нових зустрічей.
список літератури
1. Köck R., Becker K., Cookson B. et al. Methicillinresistant Staphylococcus aureus (MRSA): burden of disease and control challenges in Europe // Euro Surveill. - 2010. - 15 (41). - 19688.
2. Geiss HK, Mack D., Seifert H. Identifizierung von speziellen Resistenzmechanismen und Interpretation von Ergebnissen der AntibiotikaEmpfindlichkeitstestung bei grampositiven und gramnegativen // Erregern. Chemother J. - 2004. - 13. - 116.
3. Clinical and Laboratory Standards Institute (CLSI). Performance Standards for Antimicrobial Susceptibility Testing; 12 Informational Supplement. CLS Document M100S20 (ISBN 1562387162). - USA, 2010 року.
4. Strommenger B., Braulke C., Heuck D. et al. Spatyping of Staphylococcus aureus as a frontline tool in epidemiological typing // J. Clin. Microbiol. - 2008. - 46. - 574581.
5. Köck R., Mellmann A., Schaumburg F., Frisdrich AW, Kipp F., Becker K. The epidemiology of methicillinresistant Staphylococcus aureus (MRSA) in Germany // Dtsch. Arztebl. Int. - 2011. - 108 (45). - 7617.
6. Kohlenberg A., Schwab F., Geffers C., Behnke M., Ruden H., Gastmeier P. Timetrends for Gramnegative and multidrugresistant Grampositive bacteria associated with nosocomial infections in German intensive care units between 2000 and 2005 // Clin. Microbiol. Infect. - 2008. - 14. - 9396.
7. Lessa FC, Mu Y., Davies J. et al. Comparison of incidence of bloodstream infection with methicillinresistant Staphylococcus aureus between England and United States, 2006-2007 // Clin. Infect. Dis. - 2010. - 51. - 9258.
8. RKI: Auftreten und Verbreitung von MRSA in Deutschland 2010 // Epid. Bull. - 2011. - 26. - 23341.
9. Witte W. Communityacquired methicillinresistant Staphylococcus aureus: what do to know? // Clin. Microbiol. Infect. - 2009. - Suppl. 7. - 1725.
10. Loeffer B., Hussain M., Rundmeier M. et al. Staphylococcus aureus pantonvalentine leukocidin is a very potent cytotoxic factor for human neutrophils // Plos. Pathog. - 2010. - 6. - e1000715.
11. David MZ, Daum RS Communityassociated methicillinresistant Staphylococcus aureus: epidemiology and clinical consequences of an emerging epidemic // Clin. Microbiol. Rev. - 2010. - 23. - +61687.
12. Maier J., Melzl H., Reischl U. et al. PantonValentine leucocidinpositive methicillinresistant Staphylococcus aureus in Germany associated with travel or foreign family origin // Eur. J. Clin. Microbiol. Infect. Dis. - 2005. - 24. - 6379.
13. Stenhem M., Ortqvist A., Ringberg H. et. аl. Imported methicillinresistant Staphylococcus aureus, Sweden // Emerg. Infect. Dis. - 2010. - 16. - 18996.
14. Mollema FP, Richardus JH, Behrendt M. et al. Transmission of methicillinresistant Staphylococcus aureus to houshold contacts // J. Clin. Microbiol. - 2010. - 48. - 2027.
15. Von Eiff C., Friedrich AW, Peters G., Becker K. Prevalence of genes encoding for members of the staphylococcal leukotoxin family among clinical isolates of Staphylococcus aureus // Diagn. Microbiol. Infect. Dis. - 2004. - 49. - 157162.
16. Jappe U., Heuck D., Strommenger B. et. al. Staphylococcus aureus in dermatology outpatients with special emphasis on communityassociated methicillinresistant strains // J. Invest. Dermatol. - 2008. - 128. - 265 564.
17. European Food Safety Authority: Analysis of the baseline survey on the prevalence of methicillinresistant Staphylococcus aureus (MRSA) in holding with breeding pigs in the EU, 2008, Part A: MRSA prevalence estimates // EFSA Journal. - 2009. - 7. - 1376.
18. Cuny C., Friedrich A., Kozytska S. et al. Emergence of methicillinresistant Staphylococcus aureus (MRSA) in different animal species // Int. J. Med. Microbiol. - 2010. - 300. - 10917.
19. Fessler A., Scott C., Kadiec K., Ehricht et al. Characterization of methicillinresistant Staphylococcus aureus ST 398 from cases of bovine mastitis // J. Antimicrob. Chemother. - 2010. - 65. - +61925.
20. Cuny C., Nathaus R., Layer F., Strommenger R. et al. Nasal colonization of humans with methicillinresistant Staphylococcus aureus (MRSA) ST 398 with and without exposure to pigs // PloS One. - 2009. - 4. - e6800.
21. Grundmann H., Aanensen DM, Van den Wijngaard CC, Spratt BG et al. Geographic distribution of Staphylococcus aureus causing invasive infections in Europe: a molecularepidemiological analysis // PloS Med. -2010. - 7 (1). - e1000215.
У мене була спокуса зробити короткий огляд всіх цих колосальних зусиль по боротьбі з MRSA, але потім постало питання: а чи буде це цікаво?Після трьох статей з циклу «Бесіди з мікробіологом» хотілося б отримати feedback і дізнатися, хто він, мій співрозмовник?
Наскільки корисною була викладена інформація?
Які теми з клінічної мікробіології були б вам цікаві?
Communityacquired methicillinresistant Staphylococcus aureus: what do to know?

