1. Клонування цільової gene / ABDz1-tagged злиття побудувати
- Підготовка ПЛР фрагментів гена ABDz1 оточенні відповідні сайти рестрикції для N-термінал лигирования гена-мішені в вираженні плазміди (плазміди, що містить ABDz1 знаходиться у вільному доступі через угоди про передачу матеріалу).
- Клів очищеної вектор експресії і ПЛР-фрагменти з обрана ферментів рестрикції в потрібному буфері реакції. Purify продукти перед перев'язкою.
- Лігувати обмежена ABDz1 фрагмента в вектор експресії, що містить ген інтересу і трансформувати перев'язка продукту Е. паличка (в оригінальний метод RR1ΔM15 штам був використаний 8). Поширення трансформованих клітин на агар пластин доповнена відповідними антибіотиками для вибору.
- ПЛР екрані кілька колоній і послідовність перевірки отриманого виразу касети секвенування ДНК.
- Підготовка плазміди з нічної культури послідовності verifСВУ колонії і перейдемо до кращим штам вираз (в оригінальний метод кишкова паличка Rosetta (DE3), хостинг pRARE плазміди для поліпшення виробництва білків, кодованих генами людини, були використані).
2. Експресії білка
- Прищепити одну бактеріальну колонію в 10 мл бульйону триптичного соєвого з додаванням 5 г / л дріжджового екстракту і відповідних антибіотиків. Інкубуйте при 150 оборотів в хвилину при температурі 37 ° С протягом ночі.
- Прищепити 1 мл нічний культури в 100 мл свіжої середовища та викликають експресію білка (спочатку 1мМ ізопропіл-β-D-thiogalactoside коли лак оперона була використана), коли клітини досягають логарифмічною фазі росту.
- Інкубуйте при 150 оборотів в хвилину при 25 ° С протягом ночі і прибирання клітини центрифугуванням.
3. Ортогональні очищення спорідненістю
- Ресуспендіруют гранул в 25 мл працює буфера (25 мМ Тріс-HCl, 200 мМ NaCl, 1 мМ ЕДТА, 0,05% (вага / об'єм) Твін-20, рН 8,0) і руйнують йелектронной клітини ультразвуком при 60% амплітуди і 1.0 / 1.0 імпульсів протягом 3 хв. Центрифуга зразка і фільтр цільової білок, що містить супернатант (0,45 мкм) перед подальшої очистки.
- Врівноважуватися або 1 мл HSA Sepharose колонки або NHS-активованої колонки, раніше в поєднанні з ЧСА відповідно до рекомендацій постачальника, по 10 стовпців обсягу (CV) ведення буфером на 1 мл / хв на підходящої системи очищення білків. Навантаження бактеріальний лизат на 0,5 мл / хв, а потім скинути швидкість потоку до 1 мл / хв.
- Вимийте колонки з 5 CV ведення буфера потім 5 CV пральних буфера (5мМ NH 4 Ac, рН 5,5).
- Елюювання зразка з елюції буфера (0,5 М нас, рН 2,5) на 1 мл / хв і збирають фракції, контролювати поглинання при 280 нм, щоб вибрати з фракції елюювали пік для подальшого очищення.
- Басейн фракцій з високою концентрацією білка, розвести два рази Звичайно працює буфера (20 мМ фосфату, 150 мМ NaCl, рН 7,2) іубедітесь, що рН становить близько нейтральної. Додайте 1 М Тріс-HCl рН від 8 до збільшення рН, якщо необхідно.
- Навантаження зразка при 0,5 мл / хв на 1 мл HiTrap MabSelect Звичайно стовпець, який був врівноважену 10 CV вірних працює буфер в 1 мл / хв. Скидання швидкості потоку до 1 мл / хв після завантаження.
- Вимийте колонки з 5 CV вірних буфер працює (крок 5) і елюіруются білків з 0,2 М нас, рН 2,7. Для чутливих білків цільової елюата може бути нейтралізована безпосередньо на колекції шляхом додавання Тріс-HCl.
Якщо хроматографических стадій помінялися місцями елюата з MabSelect Звичайно, колонка може бути розведений в управлінні буфер (крок 3,1) і рН збільшилася приблизно до 8 додаванням 1 М Тріс-HCl. В цілому, більш вузькі піки спостерігаються при Звичайно матриця використовується на другому етапі.
4. Оцінка чистоти додецилсульфата натрію поліакриламідному гелі (SDS-PAGE)
- Навантаження на очищені фракціісокращеніе SDS-PAGE і, при бажанні, аналізувати молекулярний вагу очищений продукт мас-спектрометрії. Важливо в повній мірі зменшити зразка з вільних цистеїну в ABDz1 може привести до димеризации продукт, не пов'язаних з відновними умовами.
5. Представник Результати:
Як доказ принципу, ортогональні очищення близькість сприяє теги ABDz1 була оцінена на три людські білки мета, що представляють різні класи можливості розв'язання, молекулярна вага і ізоелектричної точки (табл. 1). Ген ABDz1 був злитий з генетично генів-мішеней і конструкції були виражені в E.coli, Малюнок 2 показує схему для всіх кроків в методі послідовно. Після очищення ортогональних протокол, взятих в різних точках були проаналізовані SDS-PAGE (рис. 3). Результати ясно показують, корисність подвійну мітку і дві дуже конкретні кроки очищення. Хоча розумні чистоти змінного токаhieved після початкової стадії очищення, як видно з гелів, наступний крок дає дуже чистий продукт добре підходить для дуже вимогливих додатків.
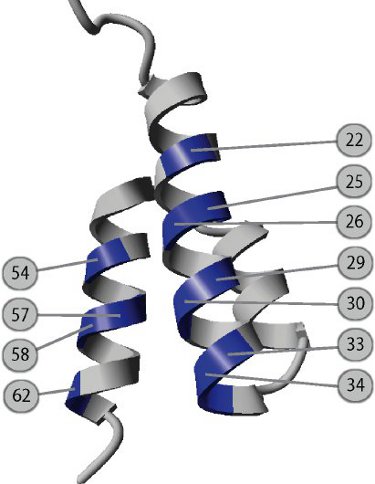
Малюнок 1. Дизайн комбінаторна бібліотека, яка використовується для вибору біспеціфічние ABDz1 тега.
46 амінокислот білка-зв'язуючий домен складки в стабільній три спіралі пучок і вона містить сайт зв'язування сироватковогоальбуміну людини в основному розташовані на другій спіралі. За генетично випадкової одинадцять поверхню піддається амінокислот знаходиться в першій і третій спіралі, роман обов'язковими поверхня була спроектована. Одинадцять Посади вказані на малюнку і пронумеровані відповідно до Kraulis і співавт. 9. Після biopanning проти димера Z-область Стафілококовий білка з комбінаторної бібліотеки, виражені на фаг, біспеціфічние ABDz1 молекули виявлено не було.
Малюнок 2. Спрощена схема для ортогональних протокол очищення близькості.
ПЛР-фрагмент, що містить послідовність ABDz1 лигируют (N-кінця) з даного гена в відповідний вектор експресії. Перев'язка продукту трансформується в E. паличка для перевірки послідовності та плазмідної ДНК. Після переходу до вираження господаря, великомасштабні культури рекомбінантного білка вираз встановлена в межах від початкової нічний культури. Бактерії збирають центрифугуванням і ціалізуватися за допомогою ультразвуку для отримання бактеріального лизата містять цільового білка. Після фільтрації крок для видалення залишків твердих частинок, лизат піддається очищенню ортогональних близькості від системи рідинного обробки, піддаючись дві стадії очистки поспіль. Елюювали піки з обох стадій очищення відбираються і оцінюються SDS-PAGE для оцінки чистоти і в порівнянні з тон лизат перед очищенням.
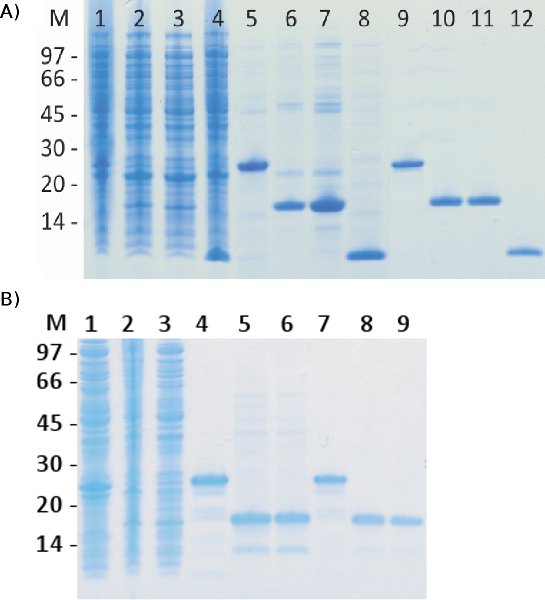
Малюнок 3. SDS-PAGE аналізу білків-мішеней виражається і очищається в злитті з ABDz1.
Зразки, взяті від бактеріальних лизат з трьох білків виражається в злитті з ABDz1, що представляють різні властивості і ABDz1 сам тег були зібрані разом зі зразками з відповідних піків від очищення на HSA-стовпчика, після якого MabSelect Sure-стовпець (). Доріжки 1-4 представляють собою зразки з лизатов до очищення, смуги 5-8 з HSA-очищення (перший ступінь) і провулків 9-12 з MabSelect Звичайно очищення (другий ступінь). Зразки завантажуються в наступному порядку: ABDz1-141377, ABDz1-HT875, ABDz1-HT2375 і ABDz1. Крім того, зразки, придбані у же лизатов очищених в зворотному порядку на тому ж колони були проаналізовані (B). Доріжки 1-3 представляють собою зразки з лизатов до очищення, провулків 4-6 єром MabSelect Звичайно очищення (перший ступінь) і провулків 7-9 з HSA-очищення (другий ступінь). Зразки були завантажені в тому ж порядку, як в (), але сам тег не входить. З цих результатів ясно, що цей двоступеневий метод дає високоочищені білки, незалежно від порядку, в якому кроки застосовуються.
Ім'я бБілка-мішені
Uniprot зМолекулярний
вага (кДа)Розчинність
Клас DМолекулярний вага
плавлення продукту (кДа)Ізоелектрична точка
плавлення продукту
141377 B7Z315 17,4 4 23,7 8,5 HT875 P01040 10,8 3 17,1 4,9 HT2375 P00740 8,9 5 15,2 6,8
- Молекулярний вага ABDz1 теги тільки на 6,3 кДа, ізоелектричної точці 6.7.
- Цільовий білок являє собою частину білка Uniprot.
- http://www.uniprot.org .
- Розчинність клас білків фрагмента з N-термінал Його 6 ABP 10.
Таблиця 1. Цільова білків і продуктів синтезу з ABDz1 теги оцінюється в доказ принципу дослідження.
Три унікальних білків людини з різною молекулярною маси, розчинність і ізоелектричної точки були обрані для вираження і очищення ортогональних підхід близькості.

