Осмот і чеський тиск е ня, дифузне тиск, термодинамічний параметр, що характеризує прагнення розчину до зниження концентрації при зіткненні з чистим розчинником внаслідок зустрічної дифузії молекул розчиненої речовини і розчинника. Якщо розчин відділений від чистого розчинника напівпроникною мембраною, то можлива лише одностороння дифузія - осмотичне всмоктування розчинника через мембрану в розчин. В цьому випадку О. д. Стає доступною для прямого виміру величиною, рівною надлишковому тиску, прикладеному з боку розчину при осмотичній рівновазі (див. осмос ). О. д. Обумовлено зниженням хімічного потенціалу розчинника в присутності розчиненої речовини. Тенденція системи вирівнювати хімічні потенціали у всіх частинах свого об'єму і перейти в стан з більш низьким рівнем вільної енергії викликає осмотичний (дифузійний) перенос речовини. О. д. В ідеальних і гранично розведених розчинах не залежить від природи розчинника і розчинених речовин; при постійній температурі воно визначається тільки числом «кінетичних елементів» - іонів, молекул, асоціатів або колоїдних часток - в одиниці об'єму розчину. Перші виміри О. д. Виробив В. Пфеффер (1877), досліджуючи водні розчини тростинного цукру. Його дані дозволили Я. X. Вант-Гофф встановити (1887) залежність О. д. від концентрації розчиненої речовини, збігається за формою з Бойля - Маріотта законом для ідеальних газів. Виявилося, що О. д. (P) чисельно дорівнює тиску, яке надало б розчинена речовина, якби воно при даній температурі знаходилось в стані ідеального газу і займало обсяг, рівний об'єму розчину. Для дуже розбавлених розчинів недіссоціірующіх речовин знайдена закономірність з достатньою точністю описується рівнянням: p V = nRT, де n - число молей розчиненої речовини в об'ємі розчину V; R - універсальна газова постійна; Т - абсолютна температура. У разі дисоціації речовини в розчині на іони в праву частину рівняння вводиться множник i> 1, коефіцієнт Вант-Гоффа; при асоціації розчиненої речовини i <1. О. д. реального розчину (p ') завжди вище, ніж ідеального (p' '), причому відношення p' / p '' = g, зване осмотичним коефіцієнтом, збільшується із зростанням концентрації. Розчини з однаковим О. д. Називається ізотонічними або ізоосмотичними. Так, різні кровозамінники і фізіологічні розчини ізотонічни щодо внутрішніх рідин організму. Якщо один розчин порівняно з іншим має більш високу О. д., Його називають гіпертонічним, а має більш низьке О. д. - гіпотонічним.
О. д. Вимірюють за допомогою спеціальних приладів - осмометрів. Розрізняють статичні і динамічні методи вимірювання. Перший метод заснований на визначенні надлишкового гідростатичного тиску по висоті стовпа рідини Н в трубці осмометрів (рис.) Після встановлення осмотичної рівноваги при рівності зовнішнього тиску p A і р Б в камерах А і Б. Другий метод зводиться до виміру швидкостей v всмоктування і витискування розчинника з осмотической осередку при різних значеннях надлишкового тиску D p = p A - р Б з подальшою інтерполяцією отриманих даних до n = 0 при D p = p. Багато Осмометри дозволяють використовувати обидва методи. Одна з головних труднощів у вимірі О. д. - правильний підбір напівпроникних мембран. Зазвичай застосовують плівки з целофану, природних і синтетичних полімерів, пористі керамічні і скляні перегородки. Вчення про методи і техніку вимірювання О. д. Називаються осмометрією. Основне застосування осмометрії - визначення молекулярної маси (М) полімерів. Значення М обчислюють з співвідношення 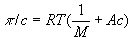 , Де с - концентрація полімеру по масі; А - коефіцієнт, що залежить від будови макромолекули.
, Де с - концентрація полімеру по масі; А - коефіцієнт, що залежить від будови макромолекули.
О. д. Може досягати значних величин. Наприклад, 4% -ний розчин цукру при кімнатній температурі має О. д. Близько 0,3 Мн / м 2, а 53% -ний - близько 10 Мн / м 2; О. д. Морської води близько 0,27 Мн / м 2.
Л. А. Шіц.
О. д. У клітках тварин, рослин, мікроорганізмів і в біологічних рідинах залежить від концентрації речовин, розчинених в їх рідких середовищах. Сольовий склад біологічних рідин і клітин, характерний для організмів кожного виду, підтримується виборчої проникністю біологічних мембран для різних солей і активним транспортом іонів. Відносна постійність О. д. Забезпечується водно-сольовий обмін , Т. Е. Всмоктуванням, розподілом, споживанням і виділенням води і солей (див. виділення , видільна система , осморегуляція ). У т. Н. гіперосмотичних організмів внутрішнього О. д. більше зовнішнього, у гіпоосмотіческіх - менше зовнішнього; у ізоосмотичних (пойкилоосмотічеських) внутрішнє О. д. дорівнює зовнішньому. У першому випадку нони активно поглинаються організмом і затримуються в ньому, а вода надходить через Біологічний. мембрани пасивно, відповідно до осмотичним градієнтом. Гіперосмотичним регуляція властива прісноводним організмам, мор. хрящових риб (акули, скати) і всім рослинам. У організмів з гіпоосмотіческая регуляцією є пристосування для активного виділення солей. У костистих риб переважаючі в океанічних водах іони Na + і Cl- виділяються через зябра, у морських плазунів (змії і черепахи) і у птахів - через особливі сольові залози, розташовані в області голови. Іони Mg2 +, 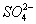 ,
,  у цих організмів виділяються через нирки. О. д. У гіпер- і гіпоосмотіческіх організмів може створюватися як за рахунок іонів, переважаючих в зовнішньому середовищі, так і продуктів обміну. Наприклад, у акулових риб і скатів О. д. На 60% створюється за рахунок сечовини і тріметіламмонія; в плазмі крові ссавців - головним чином за рахунок іонів Na + і Cl-; в личинках комах - за рахунок різноманітних низькомолекулярних метаболітів. У морських одноклітинних, голкошкірих, головоногих молюсків, миксин і ін. Ізоосмотичних організмів, у яких О. д. Визначається О. д. Зовнішнього середовища і дорівнює йому, механізми осморегуляции відсутні (виключаючи клітинні).
у цих організмів виділяються через нирки. О. д. У гіпер- і гіпоосмотіческіх організмів може створюватися як за рахунок іонів, переважаючих в зовнішньому середовищі, так і продуктів обміну. Наприклад, у акулових риб і скатів О. д. На 60% створюється за рахунок сечовини і тріметіламмонія; в плазмі крові ссавців - головним чином за рахунок іонів Na + і Cl-; в личинках комах - за рахунок різноманітних низькомолекулярних метаболітів. У морських одноклітинних, голкошкірих, головоногих молюсків, миксин і ін. Ізоосмотичних організмів, у яких О. д. Визначається О. д. Зовнішнього середовища і дорівнює йому, механізми осморегуляции відсутні (виключаючи клітинні).
Діапазон середніх величин О. д. У клітках організмів, не здатних підтримувати осмотичний гомеостаз , Досить широкий і залежить від виду і віку організму, типу клітин і О. д. Довкілля. В оптимальних умовах О. д. Клітинного соку наземних органів болотяних рослин коливається від 2 до 16 ат, у степових - від 8 до 40 ат. У різних клітинах рослини О. д. Може різко відрізнятися (так, у мангрових О. д. Клітинного соку близько 60 ат, а О. д. У судинах ксилеми не перевищує 1-2 ат). У гомойосмотіческіх організмів, т. Е. Здатних підтримувати відносну сталість О. д., Середньої величини і діапазон коливань О. д. Різні (дощовий черв'як - 3,6-4,8 ат, прісноводні риби - 6,0-6,6 , океанічні костисті риби - 7,8-8,5, акуловиє - 22,3-23,2, ссавці - 6,6-8,0 ат). У ссавців О. д. Більшості біологічних рідин одно О. д. Крові (виняток становлять рідини, що виділяються деякими залозами, - слина, піт, сеча та ін.). О. д., Створюване в клітках тварин високомолекулярними сполуками (білки, полісахариди і ін.), Незначно, але відіграє важливу роль в обміні речовин (див. онкотичноготиск ).
Ю. В. Наточин, В. В. Кабанов.
Літ .: Мелвін-Хьюз Е. А., Фізична хімія, пер. з англ., кн. 1-2, М., 1962; Курс фізичної хімії, під ред. Я. І. Герасимова, т. 1-2, М. - Л., 1963-1966; Пасинський А. Г., Поверхневі явища, 3 вид., М., 1968: Проссер Л., Браун Ф., Порівняльна фізіологія тварин, пер. з англ., М., 1967; Гріффін Д., Новик Ел., Живий організм, пров. з англ., 1973; Нобел П., Фізіологія рослинної клітини (фізико-хімічний підхід), пров. з англ., М., 1973.

Принципова схема осмометрі: А - камера для розчину; Б - камера для розчинника; М - мембрана. Рівні рідини в трубках при осмотичній рівновазі: а і б - в умовах рівності зовнішнього тиску в камерах А і Б, коли r А = r Б, при цьому Н - стовп рідини, що врівноважує осмотичний тиск; б - в умовах нерівності зовнішнього тиску, коли r А - r Б = p.

