Характеристика цікавить білка в цьому дослідженні починалася з приготування достатньої кількості рекомбінантного білка B. cereus bc1531 (rBC1531), переважно більш декількох міліграмів. Фрагмент ДНК, що кодує білок BC1531, був отриманий за допомогою ПЛР з використанням геномної ДНК B. cereus як матрицю, так як він містить ортологічние гени, ідентичні ba1554. RBC1531 був сверхекспрессірован як розчинний білок в клітинах Е. coli. Білок rBC1531 експресували 6x-гистидинового міткою і сайтом розщеплення тромбіну на своєму N-кінці 12. У якості першої стадії очищення rBC1531 очищали за допомогою нікель-афінної хроматографії (фіг.1). Потім проводили випробування на перетравлення тромбіну для визначення мінімальної кількості тромбіну, необхідного для повного розщеплення мітки спорідненості від rBC1531 (фіг. 1А). У наших руках було 0,3 одиниці тромбінаЧтоби повністю видалити тег affinity з rBC1531. Таким чином, при масштабуванні 10 мг rBC1531 обробляли 60 одиницями тромбіну для видалення мітки. Після розщеплення тромбіном без маркування rBC1531 наносять на колонку SEC для видалення будь-яких розчинних агрегатів і домішок з більш високим або низькою молекулярною вагою. Фракції rBC1531 аналізували за допомогою SDS-PAGE, результати якого показали, що rBC1531 становив ~ 99% (фіг. 1A). В цілому 1 л культури дає ~ 8 мг білка rBC1531.
Для оцінки олігомерного статусу rBC1531 проводили SEC. Стандартна лінійна крива, яка корелює логарифмічна значення молекулярних мас зразків з відповідними обсягами елюювання, була побудована з використанням піків білкових стандартів (рисунок 1B). RBC1531 елюювали при обсязі елюювання ~ 84 мл, і його удавана молекулярна маса оцінювалася як ~ 55 кДа. З огляду на, що обчислений молекулярний миІз мономера rBC1531 становить ~ 13 кДа, ці результати показують, що rBC1531 збирається у вигляді тетрамера.
Очищений rBC1531 піддавали скринінгу для кристалізації з використанням ~ 400 умов в методі дифузії парів з сидінням. Кристали rBC1531 з'являлися через ~ 2 дня при двох умовах: стан А, 0,1 М цитрат натрію (рН 5,5) і 20% ПЕГ 3000 (фіг. 2А) і стані В, 0,1 М какоділата натрію (рН 6, 5) і 1,0 М натрію цитрат (фіг.2В). Умови кристалізації оптимізували шляхом варіювання рН (0,1 М цитрату натрію, рН 5,0-6,0) і концентрації ПЕГ 3000 (18-21% ПЕГ 3000) з умови А і шляхом зміни рН (0,1 М какоділата натрію, рН 5,5-6,8) і концентрації солі (0,9-1,2 М цитрату натрію) з умови В. кристали, придатні для дифракції, були отримані тільки для умови В, тоді як кристали з умови А мали тенденцію до росту, а не до сингулярності. Кристали стану ВДіфрагірованного рентгенівського випромінювання до дозволу 2,74 Å (фіг. 2C) і використовувалися для визначення структури rBC1531.
Спостереження консервативного домену MazG в білкової послідовності BA1554 свідчить про наявність активності NTPази, здатної гідролізувати NTP. Гідроліз NTP зазвичай дає нуклеозіддіфосфат (NDP) і неорганічний фосфат (Pi) або нуклеозідмонофосфат (NMP) і пірофосфат (PPi). PPi вимагає додаткової пірофосфатазной активності для отримання Pi. Рівні Pi можуть бути безпосередньо виміряні з використанням молібдату, який утворює комплекс синього кольору з Pi (молібдат-Pi), який можна контролювати з використанням оптичної щільності на довжині хвилі 690 нм (OD 690 нм) (фіг. 3A). У нашому дослідженні після гідролізу NTP за допомогою rBC1531 після додавання молибдата не спостерігалося видимого синього кольору (фіг. 3B). Однак, коли пірофосфатази додавали до rBC1531-опосередкованого NTP-гідролізу rEaction, колір змінився на темно-синій (рис. 3B), що вказує на те, що rBC1531 володіє активністю NTP-пірофосфогідролази. Графік концентрації OD 690 нм і NTP аналізували з використанням методу нелінійної регресії для визначення кінетичних параметрів (V max 0,75 і K m 10 мкМ) для ферменту rBC1531 (фігура 3C).
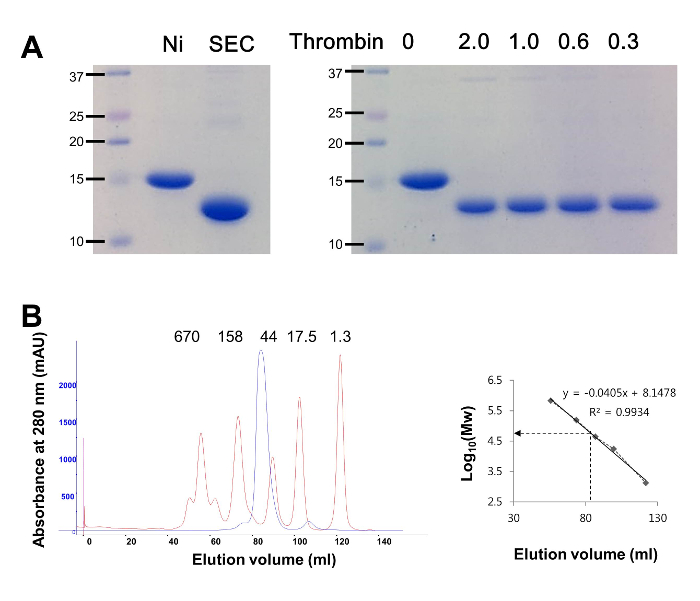
Малюнок 1: SDS-PAGE і аналіз ексклюзіонной хроматографії (SEC). (A) SDS-PAGE аналіз rBC1531. (Зліва) Піки елюювання rBC1531 від афінної хроматографії на нікелі (доріжка 2, Ni) і SEC (доріжка 3) аналізувалися разом з білковими стандартами (доріжка 1, позначені в kDa). (Праворуч) Аналіз розщеплення тромбіном rBC1531 для видалення мітки аффинности. Кількість тромбіну, доданого до 50 мкг rBC1531 в різних реакціях, становить indВ одиницях вище гелю. (B) Аналіз ексклюзіонной хроматографії (SEC) rBC1531 і білкових стандартів. (Зліва) Профілі елюювання rBC1531 (синій) і стандарти (червоний). Молекулярні маси стандартних білків показані вище кожного піку, в кДа. Вертикальна (y) і горизонтальна (x) осі показують мілі-абсорбційні одиниці (мАU при 280 нм) і обсяги утримування (мл) відповідно. (Праворуч). Відомий молекулярний розмір rBC1531 оцінювали з використанням лінійного графіка для молекулярних мас, логарифмічною шкали і обсягів елюювання білкових стандартів (R 2 = 0,9934). Натисніть тут, щоб переглянути збільшену версію цього малюнка.
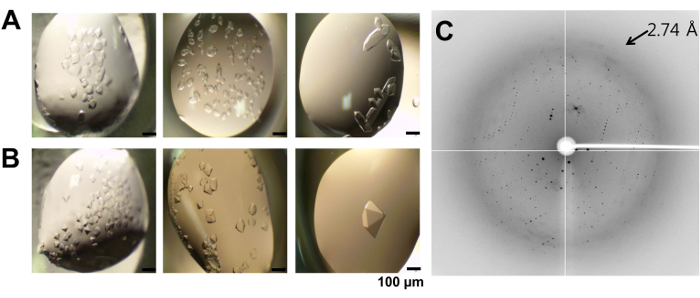
Малюнок 2: Кристалізація і дифракція рентгенівських променів. (A) кристали rBC1531 в условіяхНа-А, 0,1 М цитрату натрію (рН 5,5) і 20% ПЕГ 3000. (В) кристали rBC1531 в умовах В, 0,1 М какоділата натрію (рН 6,5) і 1,0 М цитрату натрію. Показані початкові (зліва) і оптимізовані (середній і правий) кристали. Для рентгенівської дифракції використовувався оптимізований кристал rBC1531 (праворуч, ~ 0,35 мм × ~ 0,35 мм × ~ 0,20 мм). Масштаби шкали = 100 мкм. (C) рентгенограма кристала rBC1531, отримана на пучковой лінії PAL BL-7A 12. Стрілка вказує місце з високою роздільною здатністю. Натисніть тут, щоб переглянути збільшену версію цього малюнка.
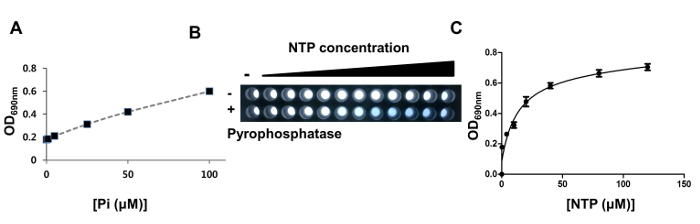
Малюнок 3: Активність NTPase. (A) Освіта комплексу молібден-Pi залежить від концентрації Pi. Оптична щільність при 690 нм дорівнює diПрямо пов'язано зі збільшенням рівнів Pi. Ось Y і вісь X є OD 690 нм і концентрацію (μM) для Pi відповідно. (B) Зміна кольору при додаванні пірофосфатази. У першому ряду лунок пірофосфатази не додають і не утворювала пі-комплекс блакитного кольору. Однак другий ряд складається з осередків, в яких реакції rBC1531-NTP обробляються пірофосфатази і мають синій колір. Значення OD 690 нм збільшувалися зі збільшенням концентрацій NTP. (C) Міхаеліс-Ментенскій ділянку реакцій rBC1531-NTP. Ось Y і вісь X є OD 690 нм і концентрацію (0-120 мкм) субстратів NTP, відповідно. Шкали помилок є стандартне відхилення для трьох окремих експериментів. Натисніть тут, щоб переглянути збільшену версію цього малюнка.

