Після видалення пухлин головного мозку може розвиватися набряк-набухання мозку іувелічіваться внутрішньочерепний тиск (ВЧД). Однією з ймовірних і найменш ізученнихпрічін цього є порушення венозного відтоку. Тяжкість клінічних проявів іісходи венозної дисциркуляции значно варіюють від головного болю і нудоти докоматозного стану і летального результату [14,17,22,26]. Варіабельність клініческойкартіни визначається кількістю сегментів венозної системи, в яких проісходітнарушеніе відтоку. Це було показано в експерименті Fries G зі співавторами [14], когдасвіньям послідовно виробляли окклюзию верхнього сагітального синуса, мостіковихі коркових вен, оцінюючи при цьому клінічний стан тварин, вимірюючи ВЧД ізміст води в тканини мозку. Було встановлено, що виражений набряк мозку, внутрішньочерепна гіпертензія (ВЧГ), руйнування гематоенцефалічного бар'єру, а потім іартеріальная гипоперфузия, яка веде до інфаркту мозку, розвивалася тільки пріодновременной оклюзії синуса, мостікових і коркових вен, коли припинявся іретроградний, і колатеральний венозний кровотік [1, 14]. У той же час встановлено, чтонаіболее виражений неврологічний дефіцит виникає при порушенні відтоку крові поглубокім і парасагіттально венах або при зацікавленості великої кількості венсільвіевой групи [24].
Загальноприйнятих протоколів корекції ВЧГ, що виникла внаслідок порушення венозногооттока, на сьогодні немає. Ми наводимо клінічне спостереження пацієнтки з менінгіомойкрила основної кістки, у якій в ранньому післяопераційному періоді гостро развілосьнарушеніе венозного відтоку і стійка ВЧГ.
Клінічне спостереження.
Хвора Ч., 47 років, поступила в Інститут з діагнозом «Опухольоснованія середньої черепної ямки зліва». При надходженні виявлялося зниження остротизренія зліва - рахунок пальців в носовій частині поля зору, лівобічний екзофтальм іпрізнакі впливу на лівий окоруховий нерв. При МРТ дослідженні головногомозку виявлена менінгіома підстави середньої черепної ямки зліва (Малюнок 1).
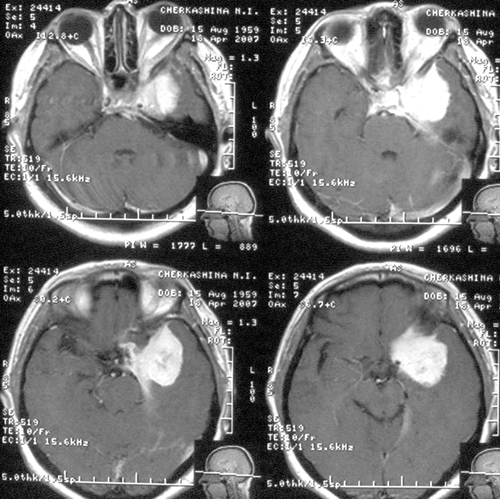
Була виконана операція - субтотальне видалення менінгіоми медіальних відділів основаніясредней черепної ямки зліва птеріональним доступом. Кавернозний синус билінфільтрірован пухлиною. Ця частина пухлини не віддалялася. Интраоперационно билікоагуліровани дві вростали в капсулу пухлини великі вени сильвиевой групи.
Крововтрата не перевищила 700 мл і була адекватно заповнена.
Пробудження з наркозного сну було в звичайні терміни. Наростання общемозговой і очаговойневрологіческой симптоматики в порівнянні з доопераційному рівнем не відзначалося.
Пацієнтка екстубіровать через 2 години після операції. Гемодинаміка була стабільною.
Гомеостатичні показники були в межах норми.
Стан різко погіршився через 12 годин після операції. Розвинулося коматозноесостояніе і правобічнийгеміпарез (3 - 4 бали). У зв'язку з дихательнойнедостаточностью хвора була інтубувати, розпочато ШВЛ в режимі SIMV + PS. ПріКТ-дослідженні головного мозку був виявлений переважно лівопівкульний набряк, масивний осередок зниженої щільності, що розташовувався в лобно-тім'яно-скроневої областіслева, відзначено зсув серединних структур зліва направо на 9 мм. Базальні цістернине візуалізувалися, шлуночкова система була компремірована (Рис. 2). Прітранскраніальной доплерографії лінійна швидкість кровотоку була в межах норми. Встановлено субдуральний / паренхіматозний датчик ВЧД (Codman, USA). Виявлено вираженнаяВЧГ (ВЧД 35 - 45 мм.рт.ст.). 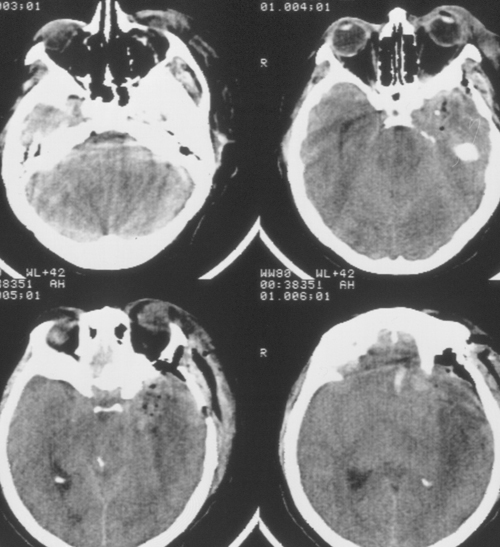
Для корекції ВЧГ використовувалися опції протоколу лікування пацієнтів з черепно-мозговойтравмой, оскільки загальноприйнятих протоколів корекції ВЧГ при порушенні венозного оттоканет. Головний кінець ліжка був піднятий на 30º. Розпочато помірна гіпервентиляція, седація пропофолом (45 мкг / кг / хв), аналгезия фентанилом (0,02 мкг / кг / хв) іміорелаксація Піпекуронія (0,5 мкг / кг / хв). Ці заходи були неефективні - ВЧД залишалося на рівні 30 - 35 мм.рт.ст. через 20 хвилин після початку терапії. Після етогобила використана осмотерапія манітолом (до 1,5 г / кг). ВЧД через 10 хвилин знизилося до20 - 25 мм.рт.ст., однак, через 30 хв знову розвинулася виражена ВЧГ (до 40мм.рт.ст.). Повторна інфузія манітолу засвідчила свою неефективність.
Було прийнято рішення про проведення помірної гіпотермії. Індукція гіпотермії началасьспустя годину після погіршення стану. Використовувалося зовнішнє охолодження і внутрівенноевведеніе охолодженого фізіологічного розчину в дозі 20 мл / кг. Температура 33º С була досягнута через дві години після індукції. ВЧД ефективно стабілізувався на рівні 10- 12 мм.рт.ст. При гіпотермії розвинулися гіпокаліємія (3,1 - 3,3 ммоль / л) ігіпомагніемія (0,39 - 0,41 ммоль / л), які були ефективно коригувати прімененіемпрепаратов калію і магнію. В якості профілактики розвитку гіпокоагуляції, учітиваяранній післяопераційний період і ефекти гіпотермії, проводилася плазмотрансфузія дозі 15 мл / кг. При цьому протромбіновий індекс був в межах 75 - 85%, актівірованноечастічно тромбопластиновий час - 28 - 33 секунди, фібриноген - 3,4 - 3,9 г / л.
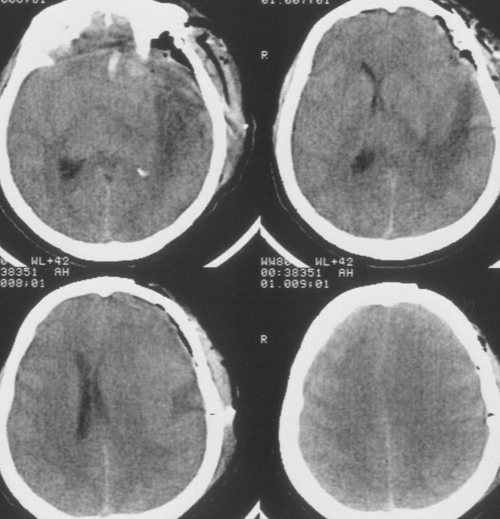
Температура тіла 33ºС підтримувалася протягом 24 годин. Перед початком зігрівання биловиполнено контрольне КТ-дослідження головного мозку, яке виявило позитивну дінамікув вигляді появи базальних цистерн і зменшення зсуву серединних структур вправо до 5мм. Однак зберігався набряк мозку і вогнище зниженої щільності в лівій півкулі (Рис 3). 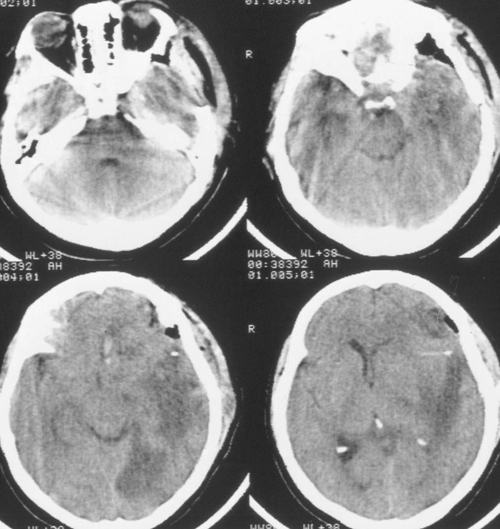
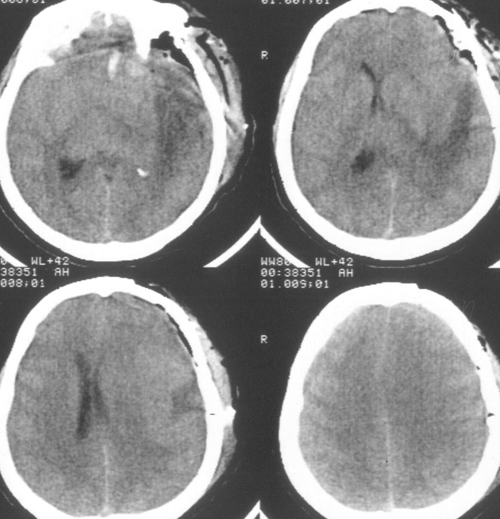
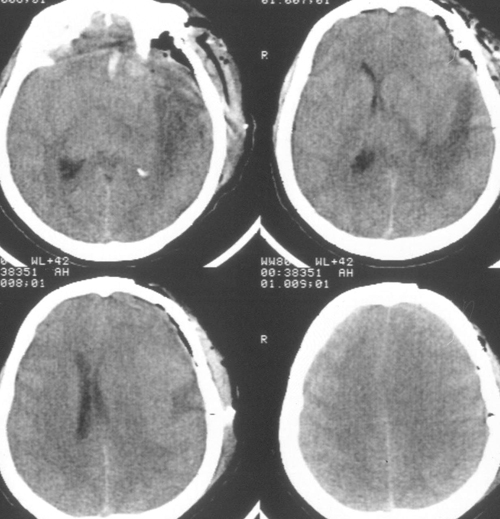
При досягненні 35ºС (через 10 годин після початку зігрівання) з'явилася отчетліваятенденція до ВЧГ, тому темп зігрівання був знижений до ≈ 0,05 градуса в годину. Внеседаціі хвора виконувала прості інструкції, правобічнийгеміпарез регресував.
Таким чином, вже на цьому етапі були виявлені позитивні ефекти гіпотермії в відерегресса загальномозковою і осередкової неврологічної симптоматики.
Температура 36ºС була досягнута через 20 годин. При цій температурі розвинулася ВЧГ до30 мм.рт.ст., резистентна до седації і осмотерапія манітолом. Це стало показаніемдля виконання зовнішньої декомпрессивной трепанації з пластикою твердої мозговойоболочкі. З протоколу операції слід, що, незважаючи на напругу твердої мозговойоболочкі, виявлене після видалення кісткового клаптя, мозок пульсувало, а при егокасаніі ні ранимий. Ймовірно, це було пов'язано з попереднім лікуванням, зокрема, - з церебропротектівнимі ефектами гіпотермії. Після розтину твердоймозговой оболонки і розширення кісткового дефекту напруга мозкового веществазначітельно зменшилася, що дозволило виконати пластику твердої мозкової оболонки безтехніческіх труднощів. Декомпресія і пластика твердої мозкової оболонки позволіліеффектівно стабілізувати ВЧД на рівні 10 - 15 мм.рт.ст.
Седация тривала ще протягом 2 діб після виконання зовнішньої декомпресії, амоніторінг ВЧД - протягом 5 діб. Протягом цього періоду епізодів внутрічерепнойгіпертензіі не було. При КТ-дослідженні була виявлена позитивна динаміка (Рісунок4). Хвора була в свідомості, але дезорієнтована в місці, часу, особистої ситуації.
Рухи виявлялися у всіх кінцівках, без виразної асиметрії. ШВЛ прекращеначерез 6 діб після декомпрессивной трепанації, а ще через 5 діб хвора переведенаіз реанімації в нейрохірургічне відділення.
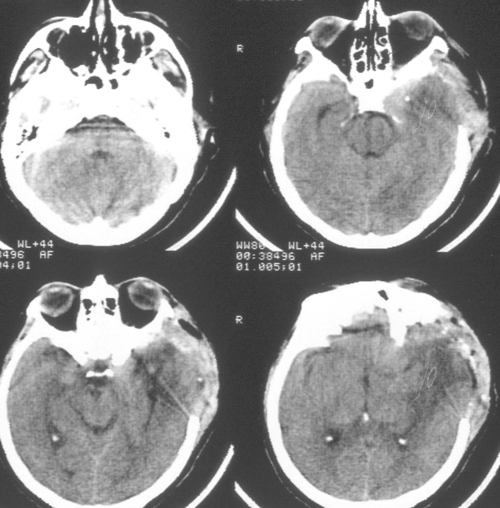

Через 1,5 місяця стан пацієнтки було стабільним. Виявлявся корсаковский синдром.
Мовних і рухових порушень не було. Було виконано МРТ-дослідження головногомозку з венографія, і в режимі дифузії (Рис 5), при якому виявлено отсутствіекровотока по поперечному і сигмовидної синуса зліва. Крім цього, діагностірованобшірний вогнище церебромаляціі лобно-скроневої області базальної локалізації зліва, який візуалізувався і при КТ-дослідженні в гострому періоді, як вогнище поніженнойплотності.
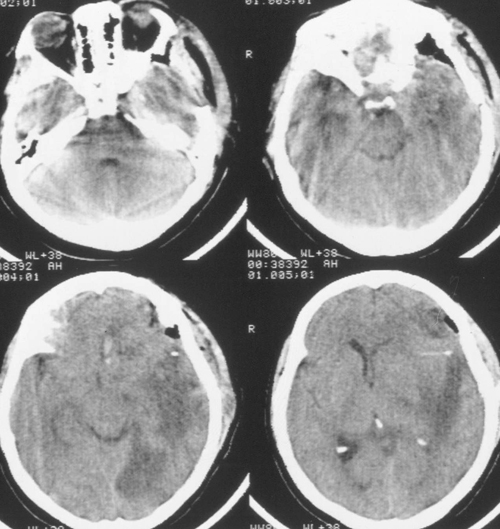
Аналіз клінічної симптоматики, даних КТ і МРТ-досліджень головного мозку позволяетпредположіть, що причиною формування цього вогнища є гостро виникло нарушеніевенозного відтоку. Крім цього, був визуализирован ішемічний вогнище в потиличній областіслева, який має конусоподібну форму і розташовується в проекції басейну заднеймозговой артерії. Найбільш ймовірна причина формування цього вогнища - компрессіязадней мозкової артерії про намет мозочка при набряку і дислокації мозку в гострому періодезаболеванія.
Через 2,5 місяця у хворої розвинулася гідроцефалія, яка з'явилася показанням длявиконання люмбоперітонеального шунтування. Через 4 місяці хвора виписана ізІнстітута в стабільному стані. Хвора могла обслуговувати себе самостійно.
Виразність корсаковского синдрому зменшилася. Через 6 місяців після випіскіпланіруется повторна госпіталізація пацієнтки для виконання пластики костногодефекта. Диференціальний діагноз при погіршенні стану пацієнтки проводився междуартеріальной ішемією і порушенням венозного відтоку. Для порушення венозного характерно: - відсутність пробудження з наркозного сну або погіршення стану через несколькочасов після операції [17]; - при КТ-дослідженні можлива візуалізація вогнища зниженої щільності в перші суткіпосле операції внаслідок гідростатичного набряку [2]; - інтраопераційні дані про пошкодження вен або синусів; - швидкість кровотоку при транскраніальної доплерографії залишається нормальною ілісніжается [4,29,30,33] .- при МРТ-венографии виявляються змінені параметри [2]. Однак виконання МРТ-дослідження в гострому періоді при наявності вираженої ВЧГ загрожує розвитком жізненноугрожающіх ускладнень.
Отже, диференціальна діагностика дозволила запідозрити у пацієнтки наявність нарушеніявенозного відтоку. Патогенез розвиненого стану можна представити таким чином.
Інтраопераційна оклюзія вен сильвиевой групи, включених в пухлину, привела клокальной венозної дисциркуляции. Відсутність кровотоку по поперечному, сігмовідномусінусу (можливо, вроджене) і кавернозному синусі (інфільтрація пухлиною) обмежувало компенсаторні можливості колатерального перерозподілу венозногооттока. Це призвело до поступового, протягом 10 - 12 годин після операції, наростаніюотека мозку, що, в свою чергу, викликало дисциркуляцію в системі глибоких вен мозку.
Це стало причиною гострого погіршення через 12 годин після операції з развітіемкоматозного стану, внаслідок вираженого набряку мозку і його дислокації.
На даний момент відсутня протокол корекції ВЧГ при порушенні венозного відтоку.
Застосування рекомендацій інтенсивної терапії для корекції ВЧГ у хворих з опухолямімозга, ЧМТ та ГПМК, в нашому спостереженні було неефективним. Глюкокортікостероідниегормони для інтенсивної терапії набряку мозку, викликаної порушенням венозного відтоку неиспольз [17,26]. Підведення головного кінця ліжка, седація, аналгезія, миорелаксация, помірна гіпервентиляція і осмотерапія були неефективні - сохраняласьВЧГ.
При неефективності перерахованих опцій для зниження ВЧД показано прімененіеагрессівних методів: барбітурова кома, зовнішня декомпресія або помірна гіпотермія.
Барбітурати не використовувалися, оскільки, зі звітів організації «Кохрановскоесотруднічество», що спеціалізується на систематизації та аналізі результатовісследованій з використанням принципів доказової медицини, слід, що: «нетдоказательств того, що терапія барбітуратами у пацієнтів з тяжкою черепно-мозговойтравмой покращує результати. Барбітурати викликають гіпотензію у каждогочетвертого пацієнта. Гіпотензивний ефект барбітуратів буде нівелювати положітельноевліяніе зниження ВЧД на церебральний перфузійний тиск ... »[28].
Зовнішня декомпрессивная трепанація була використана на цьому етапі, оскільки, поданим Greenberg MS, при порушенні венозного відтоку внаслідок венозних тромбозів онапріводіт до зниження ВЧД, але не покращує результатів захворювання [17]. При наружнойдекомпрессіі змінюються інтракраніальні співвідношення, змінюється ліквородинаміка, підвищується ризик крововиливу в залишки пухлини або вогнище ішемії при його наявності.
Відомо, що при вираженому набряку мозку після декомпресії може розвиватися ущемленіеткані мозку в кістковому дефекті з розвитком ішемії і вторинним порушенням венозногооттока на цій ділянці [11,27].
Помірна гіпотермія (32 - 34ºС) є ефективним методом контролю над ВЧД [5,7,18], і має церебропротектівним ефектом. Механізм церебропротекціізаключается в зниженні рівня метаболізму [6,9], зменшенні проніцаемостігематоенцефаліческого бар'єру [13], зменшенні концентрації збуджуючих амінокислот іпровоспалітельних интерлейкинов в пошкоджених тканинах мозку [3,15], уменьшенііперекісного окислення ліпідів [19]. Відомо, що в експериментальних і клініческіхусловіях помірна гіпотермія достовірно знижує ВЧД, зменшує зону ішеміческогоповрежденія мозку і може поліпшити результати при великому спектрі патології центральноїнервової системи: ЧМТ, ГПМК, набряк мозку після зупинки серцевої діяльності [10,16,20,23,25,31 , 32].
У наведеному спостереженні гіпотермія під час її проведення, по-перше, еффектівностабілізіровала ВЧД, по-друге, дозволила захистити мозок від ішемії. На відміну отартеріальной ішемії, що розвивається, наприклад, внаслідок клипирования артерії, прінарушеніі венозного відтоку ішемія розвивається пізніше. Спочатку з'являється вираженнийгідростатіческій набряк мозку. Саме цим маніфестувало погіршення стану впріведенном спостереженні. Якщо колатеральний або ретроградний венозний кровотокневозможен, то гостро розвивається несумісний з життям набряк мозку. При сохранностіколлатерального або ретроградного венозного кровотоку, коли можливо егокомпенсаторное перерозподіл, вираженість набряку буде значно варіювати [14]. При зберігається порушенні відтоку будуть формуватися ділянки мозку, до которимне буде надходити адекватний обсяг артеріальної крові. Внаслідок цього разовьетсяішемія. Отже, при венозній інфаркті спочатку розвивається гідростатичний набряк, а потім-ішемія і ішемічний набряк. При артеріальному інфаркті спочатку розвивається ішемія, Азат - набряк. Оскільки в наведеному спостереженні при досягненні нормотермии був регрессправостороннего гемипареза і відновлення свідомості, а в подальшому не билодвігательних порушень, то гіпотермія, ймовірно, мала церебропротектівний ефект. Крім цього, проведена гіпотермія забезпечила адекватні умови для виконання впоследующем зовнішньої декомпресії.
Гіпотермія є агресивним методом корекції ВЧГ. Найбільш часто описуються в літературі ускладненнями є гипокоагуляция [8,35], водно-електролітні порушення [21], гемодинамічнірозлади [12,34] та інфекційно-запальні ускладнення [8,34]. Найбільш грізними проявами гіпокоагуляції є інтракраніальниекровоізліянія. Це зумовило профілактичне використання свіжозамороженої плазми впріведенном спостереженні. Водно-електролітні порушення при гіпотермії проявляютсягіпокаліеміей і гіпомагніємією [21]. Гемодинамічнірозлади проявляються обичносінусовой брадикардією. Описано небезпечніші порушення ритму - асистолія і фібрілляціяжелудочков, однак, вони розвиваються або при температурі менше 28ºС або при длітельностігіпотерміі більше 48 годин [8,12,34]. Розвинені в наведеному спостереженні гіпокаліємія, гіпомагніємія та гемодинамічно незначна брадикардіяне погрожували вітальним функцій ібули коригувати негайно при їх розвитку. Таким чином, помірна гіпотерміяпоказала себе відносно безпечним методом контролю над ВЧД.
Період зігрівання є важливим етапом в проведенні гіпотермії. У нашому наблюденііпрі согревании з'явилася тенденція до підвищення ВЧД. Це узгоджується з даними рядаавторов. Так, Schwab S зі співавторами показали, що зігрівання - це період високогоріска розвитку повторної і стійкою ВЧГ, яка може призводити до летального результату [31,32]. Автори довели, що тривалість зігрівання, що перевищує 16 годин, достовірно зменшує летальність. Тому швидкість зігрівання в нашому наблюденіісоставіла ≈ 0,05º на годину. Не дивлячись на це, поступово розвинулася стійка ВЧГ, чтостало показанням до виконання зовнішньої декомпрессивной трепанації з пластикою твердоймозговой оболонки. Обрана тактика дозволила не допустити посилення дислокації мозку ісохраніть структурність паренхіми мозку до моменту декомпресії.
Дані літератури и наше спостереження свідчать про ті, что гіпотермія за счетсвоего церебропротектівного ЕФЕКТ, дозволяє Зменшити зону Вже сформіровавшегосяішеміческого вогнища и не допустіті Подальшого ішемічного пошкодженню. Однак в періодсогреванія зберігається ризики розвитку повторної резістентної ВЧГ. У цих условіяхнеобходімо виконувати зовнішню декомпресію з пластикою твердої мозкової оболонки.
Гіпотермія в цьому випадку буде створювати більш сприятливі умови для виполненіяопераціі.
На закінчення необхідно сказати, що у пацієнтів з пухлинами базальної локалізації брехні післяопераційному періоді можливий розвиток набряку мозку внаслідок нарушеніявенозного відтоку. При цьому стрімко розвивається стійка ВЧГ. Діфференціроватьнарушеніе венозного відтоку від інших можливих причин розвитку набряку мозку в остромперіоде досить складно. Однак цей стан завжди необхідно розглядати в як можливої причини розвитку стійкої ВЧГ. Помірна гіпотермія являетсяеффектівним і безпечним методом корекції набряку мозку і ВЧГ при порушенні венозногооттока. Внутрішньочерепна гіпертензія, що розвинулася на етапі зігрівання, являетсяпоказаніем до виконання зовнішньої декомпресії. І, звичайно, необхідні дальнейшіеісследованія в цьому цікавому і перспективному напрямку.
література
- Беків Д.Б., Михайлов С.С. «Атлас артерій і вен головного мозку людини», М. Медицина, 1979, стор. 95-96.
- Корнієнко В.Н., Пронін І.М. Діагностична нейрорадіалогія. М. Видавництво Андрєєва Т.М., одна тисяча триста шістьдесят вісім стр. 2007.
- Aibiki M, Maekawa S, Ogura S, et al: Effects of moderate hypothermia on systemic and internal jugular plasma IL-6 levels after traumatic brain injury in humans. J Neurotrauma 1999; 16: 225-232.
- Alexandrov A, Joseph M: Transcranial Doppler: An Overview of its Clinical Applications. The Internet Journal of Emergency and Intensive Care Medicine 2000; Vol. 4, №1 (ISSN: 1092-4051).
- Bayir H, Clark RSB, Kochanek PM Promising strategies to minimize secondary brain injury after head trauma. Crit Care Med 2003; 31: S112-S117.
- Berntman L, Welsh FA, Harp JR: Cerebral protective effect of low-grate hypothermia. Anesthesiology 1981; 55: 495-498.
- Bernard SA, Buist M Induced hypothermia in critical care medicine: A review. Crit Care Med 2003; 31: 2041-2051.
- Bernard SA. Therapeutic hypothermia after cardiac arrest: Now a standard of care * . Crit Care Med 2006; Vol. 34 P 923-924.
- Chopp M, Knight R, Tidwell CD, et al: The metabolic effects of mild hypothermia on global cerebral ischemia and recalculation in the cat: Comparison to normothermia and hyperthermia. J Cereb Blood Flow Metab 1989; 9: 141-148.
- Colbourne F, Sutherland G, Gorbett D: Postischemic hypothermia: A critical appraisal with implications for clinical treatment. Mol Neurobiol 1997; 14: 171-201.
- Csokay A, Pataki G, Nagy L, Belan K. Vascular tunnel construction in the treatment of severe brain swelling caused by trauma and SAH. (Evidence based on intra-operative blood flow measure). Neurological research 2002; 24: 157-160.
- Danzl DF, Pozos RS: Accidental hypothermia. N Engl J Med 1994; 331: 1756-1760.
- Dietrich WD, Busto R, Halley M, et al: The importance of brain temperature in alterations of the blood-brain barrier following cerebral ischemia. J Neuropathol Exp Neurol 1990; 49: 486-497.
- Fries G, Wallenfang T, Hennen J, et al Occlusion of pig superior sagittal sinus, bridging and cortical veins: multistep evolution of sinus-vein thrombosis. J. Neurosurg. 1992; 77: 127-133.
- Globus MY, Alonso O, Dietrich WD, et al: Glutamate release and free radical production following brain injury: Effects of posttraumatic hypothermia. J Neurochem 1995; 65: 1704-1711.
- Goto Y, Kassell NF, Hiramatsu K, et al: Effects of intraischemic hypothermia on cerebral damage in a model of reversible focal ischemia. Neurosurgery 1993; 32: 980-984.
- Greenberg MS. Handbook of neurosurgery. pp 609,611,891. Thieme, 2001..
- Hofmeijer J, van der Worp H, Kappelle LJ Treatment of space-occuring cerebral infarction. Crit Care Med 2003; 31: 617-625.
- Karibe H, Chen SF, Zarow GJ, et al: Mild intraischemic hypothermia suppress consumption of endogenous antioxidants after temporary focal ischemia in rats. Brain Res 1994; 649: 12-18.
- Kawai N, Okauchi M, Morisaki K, et al: Effects of delayed intraischemic and postischemic on a focal model of transient cerebral ischemia in rats. Strake 2000; 31: 232-239.
- Koht A, Cane R, Cerullo LJ: Serum potassium levels during prolonged hypothermia. Int Care Med 1983; 9: 275 - 277.
- Kurita H, Shin M, Ueki K, Kawamoto S, Kirino T. Congestive brain oedema associated with a pial arteriovenous malformation with impaired venous drainage. Acta Neurochir. 2001; 143: 339-342.
- Maier CM, Sun GH, Kunis D, et al: Delayed induction and long-term effects of mild hypothermia in a focal model of transient cerebral ischemia: Neurological outcome and infarct size. J Neurosurg. 2001; 94: 90-96.
- McElveen WA, Gonzales RF, Keegan AP: Cerebral venous thrombosis. E-medicine ( http://www.emedicine.com/neuro/topic642.htm ), 2006.
- Nolan JP, Morley PT, Hoek TL, et al: Therapeutic hypothermia after cardiac arrest. An advisory statement by the Advancement Life support Task Force of the International Liaison Committee on Resuscitation. Resuscitation 2003; 57: 231-235.
- Park JH, Yoon SH New concept of cerebrospinal fluid dynamics in cerebral venous sinus thombosis. Medical Hypotheses 2007, article in press.
- Polin RS, Shaffrey ME, Bogaev CA. Decompressive bifrontal craniectomy in the treatment of severe post-traumatic cerebral edema. Neurosurgery 1997; 41: 84-92.
- Roberts I. Barbiturates for acute traumatic brain injury. Cochrane Database of Systematic Reviews [computer file] 2005 (2): CD000033.
- Saqqur M, Zygun D, Demchuk A: Role of transcranial Doppler in neurocritical care. Crit Care Med 2007; 35 (5) Suppl May: S216-S223.
- Schreiber SJ, Stolz E, Valdueza JM: Transcranial ultrasonography of cerebral veins and sinuses. Eur J Ultrasound 2002 Nov; 16 (1-2): 59-72.
- Schwab S, Georgiadis D, Berrouschot J, et al: Feasibility and safety of moderate hypothermia after massive hemispheric infarction. Stroke 2001; 32: 2033-2035.
- Schwab S, Schwarz S, Spranger M, et al: Moderate hypothermia in the treatment of patients with severe middle cerebral artery infarction. Stroke 1998; 29: 2461-2466.
- Stolz E, Kaps M, Kern A, et al .: Transcranial color-coded duplex sonography ofintracranial veins and sinuses in adults. Reference data from 130 volunteers. Stroke тисяча дев'ятсот дев'яносто дев'ять May; 30 (5): 1070 - 1075.
- The hypothermia after cardiac arrest study group: mild therapeutic hypothermia to improve the neurological outcome after cardiac arrest. New Engl J Med 2002; 346: 549-556.
- Valeri CR, MacGregor H, Cassidy G, et al: Effects of temperature on bleeding time and clotting time in normal male and female volunteers. Crit Care Med 1995; 23: 698-704.

