 Вступ
Вступ
Гепатоцеребральная дегенерація (ГЦД) (хвороба Вільсона - Коновалова) - важке спадкове прогресуюче аутосомно-рецесивне захворювання. Розвиток захворювання визначає ген ATP7B, який розташований на довгому плечі 13-й хромосоми і кодує трансмембранний білок АТФазу Р-типу, який вбудовує молекулу міді в апоцерулоплазмін і здійснює виділення міді в жовч [4, 38].
При гепатоцеребральной дегенерації порушується баланс між надходженням і екскрецією міді. З їжею в добу надходить в організм від 2 до 5 мг міді. У нормі екскреція міді з жовчю становить близько 2 мг на добу, а при ГЦД - лише 0,2-0,4 мг. Що залишається вільна, не пов'язана з церулоплазміном токсична мідь відкладається в печінці, структурах головного мозку і очі, нирках та інших органах. Клінічні прояви залежать від нагромадилося кількості вільної токсичної міді в тих чи інших органах [9, 19, 27].
ГЦД - відносно рідкісне захворювання. Частота гомозиготного носійства (клінічно проявляється) становить 1 на 200 тис. Населення. Поширеність гетерозиготного носійства в тисячу разів більше (1: 200). При гетерозиготному стані відсутні виражені клінічні прояви хвороби, а є лише зміни біохімічних показників метаболізму міді. ГЦД зустрічається частіше, ніж діагностується. Постановка діагнозу, а отже, і призначення ефективного лікування часто запізнюються на кілька років. Необхідно також враховувати, що це одне з небагатьох спадкових захворювань, що піддаються лікуванню [7, 9, 15].
Головний мозок є одним з головних депо, де накопичується вільна токсична мідь, яка викликає різного ступеня вираженості деструктивні зміни в його структурах.
Фундаментальне опис патоморфологии головного мозку при ГЦД належить Н.В. Коновалову [3]. Він переконливо показав поширений характер патоморфологического процесу в сірій речовині структур головного мозку, в тому числі і корі великих півкуль.
Все патоморфологічні зміни головного мозку при ГЦД діляться на ангіотоксіческіе і цитотоксичні. Ангіотоксіческій компонент ураження головного мозку виражається в атонії дрібних судин і капілярів мозку, в результаті чого виникають стази, дрібні крововиливи і периваскулярний набряк. Ці порушення ведуть до ішемії і аноксії нервової тканини з наступною її загибеллю. Дисциркуляторні розлади відзначаються переважно в зонах сірої речовини головного мозку з багато розвиненою судинною системою. Хронічна гепатогенній інтоксикація і накопичення вільної токсичної міді в головному мозку призводять до поширених дистрофічних змін нервових клітин, які часто є причиною їх загибелі. Характерно поява в глії гігантських клітин Альцгеймера [2, 3, 5, 6, 8, 11, 12].
Прижиттєво у хворих ГЦД морфологічні зміни в головному мозку виявляються за допомогою нейровізуалізації. Згідно з даними літератури, структурні вогнищеві зміни частіше зустрічаються у вигляді двосторонніх симетричних ділянок в області базальних гангліїв, без ознак перифокального набряку. Аналогічні осередки виявляються і в таламусі, стовбурі і мозочку. Частина авторів також відзначають в мозку цих хворих і атрофічний процес головного мозку [1, 10, 13, 25].
JM Trocello et al. [37], обстеживши 81 хворого з ГЦД і поряд з пошкодженням підкіркових вузлів у 23,4% хворих, відзначили поразку corpus callosum. Автори стверджують, що це є дуже важливим підтвердженням ГЦД.
M. Sudmeyer et al. [30] провели МРТ-дослідження в трьох групах пацієнтів: 6 осіб з хворобою Вільсона, в статусі яких був тремор, 6 осіб з хворобою Вільсона, але без моторного дефіциту, і третю групу склали 10 практично здорових осіб. Результати дослідження показали, що в першій групі хворих, в статусі яких був тремор, відзначалося істотне симетричне Т2-зважене гіпоінтенсівное зміна сигналу від блідої кулі, верхній частині хвостатого ядра і субстанції Нигра. Дані МРТ групи хворих без тремору не відрізнялися від даних МРТ, отриманих в групі здорових осіб.
Частина авторів, провівши МРТ-дослідження в динаміці, показали її ефективність для контролю лікувального процесу у хворих ГЦД.
TJ Kim et al. [23] провели до і після лікування МРТ-дослідження великої групи хворих дітей. У дослідження було включено 50 пацієнтів з хворобою Вільсона. Неврологічна симптоматика була відзначена у 17 пацієнтів. У 33 хворих дітей не було неврологічної патології, але були порушення функції печінки. Автори відзначають кореляцію між даними МРТ і неврологічною симптоматикою у хворих дітей. У тих же випадках, коли немає цієї відповідності, вони кажуть, що у цих хворих функціональні порушення передували морфологічним, структурних змін мозку. Більш того, вони припускають, що, можливо, існує у дітей дві форми хвороби Вільсона: неврологічна і печінкова.
S. Sinha et al. [36] обстежили за допомогою МРТ в динаміці до і після лікування 50 хворих ГЦД. У цих хворих середній вік дебюту захворювання склав 12,8 ± 5,6 року. Вихідна МРТ у всіх хворих була патологічно зміненої і характеризувалася наявністю атрофії, яка частіше носила дифузний характер, кори головного мозку і мозочка, а інтенсивність сигналу могла бути фокальній або мультифокальної, симетричною або асиметричною. У 4 хворих було виявлено характерне для даного захворювання МРТ-зміна у вигляді морди гігантської панди. Протягом 2-3 років лікування у 36 з 50 хворих було відзначено клінічне поліпшення. З боку МРТ поліпшення було відзначено у 35 пацієнтів, незначні зміни - у 10 пацієнтів і погіршення - у 4 хворих.
Динаміку МРТ-даних після проведеного успішного лікування відзначали й інші автори [33, 34].
В одиничних роботах показані кореляційні зв'язки між даними МРТ і даними нейропсихологічних обстежень.
John Wiley [21] на підставі обстеження за допомогою МРТ і ретельного нейропсихологічного обстеження 20 пацієнтів з хворобою Вільсона знайшов істотну позитивну кореляційний зв'язок (r = 0,535) між погіршенням пізнавальних функцій і структурними порушеннями на МРТ. Особливо, якщо сигнал на МРТ високої інтенсивності поєднувався з атрофією (r = 0,718).
A. Shanmugiah et al. [35] провели МРТ-дослідження у хворих з психічними проявами хвороби Вільсона і відзначили поширену атрофію кори головного мозку, мозочка і стовбура головного мозку. Збільшення інтенсивності МР-сигналу було відзначено в області хвостатого ядра, внутрішньої капсули, таламуса і середнього мозку. МР-спектроскопічно були відзначені збільшення сигналу справа і дефіцит дофамінергічних (D2) рецепторів в підкіркових гангліях. Зазначеними порушеннями в лимбических структурах мозку A. Shanmugiah et al. [35], S. Sinha et al. [36] і Kaladjian et al. [22] намагаються пояснити розвиток у хворих на хворобу Вільсона біполярних психічних порушень.
В останні роки з'явилася можливість за допомогою МР-спектроскопії визначати in vivo в різних структурах головного мозку локальні метаболічні процеси [16]. Публікації з питання MP-спектроскопії у хворих з ГЦД недостатні і суперечливі. AJ van den Heuvel et al. [39], A. Alanen et al. [14], R. Jauasundar еt al. [20] показали істотні зміни метаболічних процесів в різних структурах головного мозку, в той час як H. Nazer et al. [32], Е. Kraft [26] не знайшли таких змін.
Т. Leandro et al. [28] провели МР-спектроскопическое обстеження 36 хворих з ГЦД і 37 здорових добровольців. Було показано, що в тім'яно-потиличних областях кори головного мозку в групі хворих були достовірно зменшені співвідношення креатин / N-ацетіласпартат і креатин / холін, а також збільшено в базальних ядрах мозку співвідношення миоинозитола / креатин. Автор вважає, що дані МР-спектроскопії вказують на втрату нейронів в обстежених областях кори головного мозку і на залізисті і мідні відкладень в базальних ядрах головного мозку.
A. Mueller et al. [31] МР-томографічне і МР-спектроскопічно обстежили 24 пацієнта з хворобою Вільсона. 11 хворих мали тільки печінкові ознаки захворювання, а у 13 хворих були неврологічні прояви хвороби. Всім пацієнтам були проведені тести на порогове сприйняття і ідентифікацію запаху. Результати показали, що у хворих з неврологічними ознаками більш грубо порушені нюхові функції, ніж у хворих тільки з печінковими проявами захворювання. Хворі з більш вираженою неврологічною симптоматикою мають і більш грубі порушення нюху. Автори не знайшли значною кореляції між регіональним рівнем метаболізму глюкози і показниками МРТ підкіркових гангліїв.
Останнім часом в літературі з'явилися дані про те, що і транскраніальна сонографія (TCS) є надійним і чутливим методом у виявленні структурних змін у хворих з паркінсонізмом і іншими кортікобазальнимі дегенерації [18, 29].
Наведені дані літератури показують, що багато питань структурно-функціонального взаємини при ГЦД дискусійні і остаточно не вирішені. Немає єдиної думки про характер Т2-зважених зображень (ВІ) патологічного МР-сигналу від підкіркових гангліїв. Одні автори знаходили сигнали високої інтенсивності, а інші - гіпоінтенсівние. Розходяться думки дослідників про частоті та вираженості атрофічних змін структур головного мозку. Не ясно, за рахунок яких механізмів йде зменшення атрофічних процесів головного мозку, не знайдений відповідь на питання, чому не завжди МРТ-дані корелюють з клінічним перебігом захворювання, чому у частини хворих при поліпшенні клінічної картини немає поліпшення МРТ-даних або навіть відбувається їх погіршення , і не ясно, чому страждають переважно підкіркові вузли великого мозку. Суперечливі думки і про цінності МР-спектроскопії у хворих ГЦД.
матеріали та методи
У нашій роботі наведені результати МРТ-обстеження 32 хворих ГЦД. Жінок було 12, чоловіків - 20. На період обертання в інститут середній вік хворих склав 28,6 року. Віковий діапазон хворих був від 20 до 50 років.
Вік хворих до появи перших симптомів захворювання склав в середньому 23,2 року, коливання від 10 до 37 років. Час від появи перших симптомів захворювання до постановки остаточного діагнозу, а отже, і почала етіопатогенетичної терапії склало в середньому 2,2 року і коливалося від 0 до 7 років.
Діагноз ГЦД ставилося або підтверджувався в клініці інституту на підставі наявності кілець Кайзера - Флейшера, зниження вмісту в сироватці крові церулоплазміну (нижче 20 мг / дл) і збільшення екскреції міді з сечею (більше 100 мкг / добу).
Аналіз клінічної картини у обстежених нами хворих виявив поліморфну неврологічну симптоматику з переважанням ураження екстрапірамідної системи. Залежно від провідних неврологічних симптомів хворі були розподілені наступним чином: найбільшу кількість хворих (13 чол.) Мало дрожательную форму захворювання, у 11 пацієнтів була тремтливий-ригидная форма ГЦД, у 3 - екстрапірамідні-коркова, у 3 хворих - черевна, арітмогіперкінетіческая ( рання) форма була у 2 хворих.
МРТ-обстеження проводилося за допомогою томографа з напруженістю магнітного поля 1,5 Тл в режимах Т1, Т2-ВІ і Т2-Flair в сагітальній, аксіальної і фронтальній площинах.
Для визначення метаболічних змін в структурах головного мозку 26 хворим ГЦД була проведена одновоксельная МР-спектроскопія за воднем як в області базальних ядер, так і в білій речовині півкуль мозку. МР-спектроскопічно ми визначали показники трьох метаболітів: NAA, Cr, Cho.
N-ацетіласпартат (NAA) - нейрональне маркер. Присутній в тілах нейронів і аксонах. При патологічних станах зниження рівня NAA вказує на втрату нейронів, що має місце при ішемії і дегенеративних захворюваннях мозку.
Холін (Cho) - маркер клітинних мембран. Його рівень підвищується при проліферації клітин і знижується при дегенерації і некрозу.
Креатин (Cr) - маркер аеробного метаболізму клітин головного мозку. Його концентрація в сірій речовині мозку вище, ніж в білому. Цей метаболіт використовується як внутрішній стандарт для розрахунку концентрації інших метаболітів, так як він є найстабільнішим і не залежить від рівня оксигенації і перфузії [17].
МР-спектрограми є графік з піків, відповідних окремим метаболитам.
Для інтерпретації МР-спектрограм вимірювалися амплітуда і ширина піків і проводилося обчислення відношення амплітуди і піку NAA до піку Cr і ставлення піку Cho до піку Cr.
Вивчалися показники МРТ і МР-спектроскопії, характерні як для загальної групи хворих ГЦД, так і в залежності від форми захворювання (арітмогіперкінетіческая, абдомінальна, тремтливий-ригидная, тремтливий, екстрапірамідні-коркова), почала і тривалості захворювання.
результати
Показники МРТ підтвердили клінічні дані про те, що у хворих ГЦД переважає ураження структур екстрапірамідної системи. З 32 хворих патологічні зміни на МР-томограмах в області підкіркових вузлів були виявлені у 28 хворих (87,5%). У 14 хворих (43,75%) в патологічний процес були симетрично залучені як шкаралупа, так і блідий кулю, тобто все сочевицеподібне ядро (рис. 1).
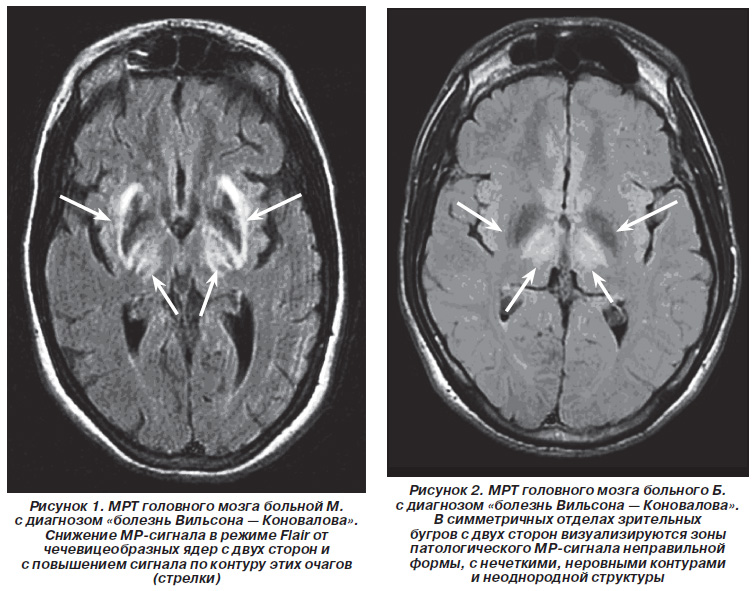
У 12 хворих (37,5%) патологічні зміни МР-сигналу були виявлені тільки в області блідої кулі. У 4 хворих (12,5%) патологічні зміни МР-сигналу відзначалися в області зорових горбів (рис. 2).
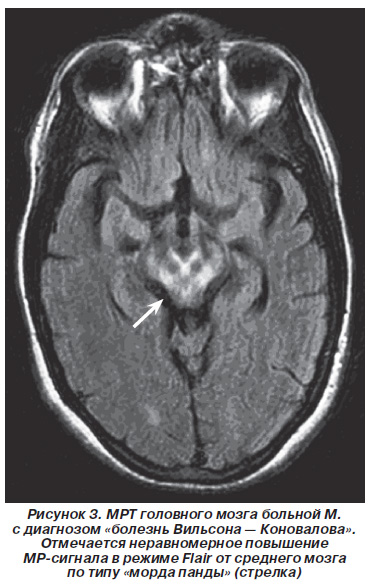
У 4 хворих (12,5%) відзначалося нерівномірне підвищення МР-сигналу на Т2-ВІ від середнього мозку за типом «морда панди». Багато авторів вважають цей знак досить характерним для хвороби Вільсона - Коновалова [36] (рис. 3).
У ніжках мозку і мозочка у 6 хворих (18,75%) візуалізувалися зони патологічного МР-сигналу неправильної форми з нерівними контурами і неоднорідну структуру (переважно слабогіперінтенсівний на Т2-ВІ і -Flair і слабогіпоізоінтенсівний на Т1). Подібні осередки у 2 хворих (6,25%) були виявлені в області довгастого мозку.
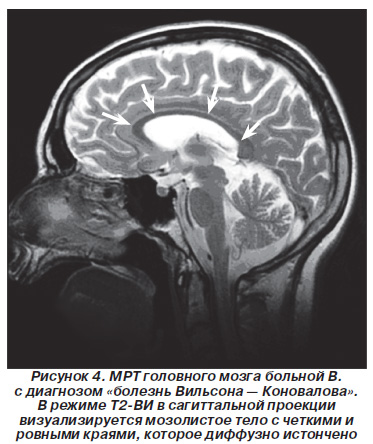
У 7 хворих (21,9%) мозолисте тіло з відносно чіткими і рівними краями було дифузно стоншена (рис. 4).
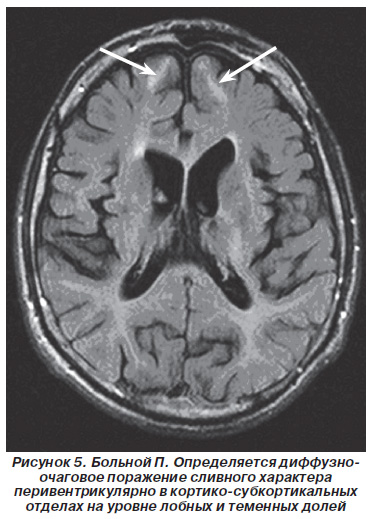
У 10 хворих (31,25%) відзначалися зміни інтенсивності МР-сигналу в області лобових, скроневих і тім'яних доль великого мозку (рис. 5).
У 8 хворих (25,0%) визначалося помірне зниження МР-сигналу на Т2-ВІ від сочевицеподібних ядер з двох сторін, але з підвищенням сигналу по контуру цих вогнищ (рис. 1).
Необхідно відзначити, що у більшості наших хворих (22 особи - 68,75%) відзначалася на Т2-ВІ гіпоінтенсівность патологічних МР-сигналів від базальних гангліїв великого мозку і лише у 4 хворих (12,5%) визначалася гіперінтенсивного сигналу на Т2-ВІ .
Шлуночкова система і субарахноїдальний-конвекситальной простору в тій чи іншій мірі були збільшені і розширені у всіх обстежених хворих з ГЦД.
У загальній групі обстежених нами хворих з ГЦД (32 чол.) Лише у 4 хворих (12,5%) не було патологічно змінених МРТ-сигналів від базальних ядер великого мозку. Однак зазначалося розширення шлуночкової системи і конвекситальних субарахноїдальних просторів, що вказувало на наявність у цих хворих атрофічні зміни з боку структур великих півкуль головного мозку.
У всіх чотирьох випадках захворювання починалося з абдомінальної форми ГЦД, де домінуючими були суб'єктивні та об'єктивні ознаки ураження печінки. У однієї хворої з них в 17-річному віці був діагностований цироз печінки з едемою синдромом. Через три роки після неефективного консервативного лікування була проведена ортотопіческая трансплантація трупної печінки. У всіх чотирьох хворих не було виявлено кілець Кайзера - Флейшера. З боку психоневрологічного статусу у них відзначалися тремор кінцівки, пластична м'язова гіпертензія, порушення мови по дизартрические типу. У всіх була виражена астенізація, порушення продуктивності когнітивних функцій за органічним типом, а також тривожно-депресивні переживання.
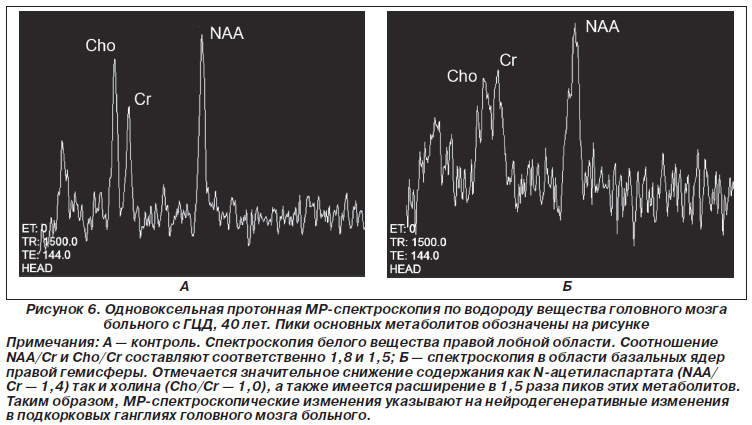
Згідно з отриманими МР-спектроскопическим даними, у наших хворих ГЦД співвідношення NAA / Cr в підкіркових гангліях склало 1,42 ± 0,19, а в білій речовині лобових областей - 1,55 ± 0,20.
Співвідношення Cho / Cr в базальних гангліях у більшості хворих майже не відрізнялося від контролю в білій речовині, і лише у 4 хворих воно було знижено. Можливо, це зниження пояснюється тим, що у цих хворих був виражений цироз печінки.
У більшості хворих (77%) відзначалося розширення піків всіх визначених нами метаболітів в базальних гангліях півкуль головного мозку. Наші показники виявилися трохи більшими, ніж у T. Leandro et al. [28] (рис. 6).
Обговорення
Згідно з даними літератури, отриманим в основному при дослідженні хворих дитячого віку, відзначається, що від підкіркових гангліїв у хворих ГЦД реєструються на T2-ВІ МР-сигнали високої інтенсивності [25]. У наших хворих в 68,75% випадків відзначалася від підкіркових гангліїв гіпоінтенсівность на T2-ВІ патологічних МР-сигналів. Гіпоінтенсівность МР-сигналу на Т2-ВІ від підкіркових гангліїв відзначали і M. Sudmeyer et al. [30].
Дане розбіжність, очевидно, пов'язано з віковою різницею хворих і тривалістю їх захворювання. У дитячому віці це ще гострий період захворювання з накопиченням міді, який може супроводжуватися набряком мозку. У той час як довго поточний захворювання обумовлює процес демієлінізації і кістозної дегенерації. Про це говорить і той факт, що у хворих, які тривалий час приймали купреніл, частіше в підкіркових гангліях відзначається не гіперінтенсівний сигнал на Т2-ВІ, а гіпо- або нормотензівной, що можна пояснити зменшенням в гангліях кількості вільної міді і вираженості набряку, а також розвинувся кістозним процесом.
Цим же віковим і особливо тимчасовим фактором можна пояснити і яку ми здобули високий відсоток хворих ГЦД з дифузними атрофічними змінами головного мозку.
У нашому дослідженні у 4 пацієнтів був відзначений, як і у деяких інших авторів, на МРТ в блідій кулі і шкаралупі сигнал низької інтенсивності, оточений по периферії сигналом високої інтенсивності на Т2-ВІ. Частина авторів центральну область сигналу низької інтенсивності пояснюють як результат підвищеного депонування заліза в ділянках з акумуляцією міді [24]. Однак дане явище може бути пояснено і як наслідок атрофії з кістозними утвореннями і явищем гліозу після терапії хелатами міді. Наше становище підтверджують і дані TJ Kim et al. [23].
Отримане нами при МР-спектроскопії зниження співвідношення NAA / Cr вказує на зменшення концентрації NAA, тобто нейронного маркера, що підтверджує наявність нейродегенеративне процесу в базальних гангліях мозку хворих ГЦД.
Зменшення у 5 хворих співвідношення NAA / Cr в білій речовині лобових областей півкуль головного мозку, де МР-томографічне не виявляються структурні зміни мозку, може вказувати на те, що біохімічні зміни при ГЦД можуть відбуватися не тільки в сірій речовині підкіркових вузлів, але і у всіх структурах головного мозку.
Клініко-Нейровизуализационное зіставлення показало, що чим важче клінічний перебіг хвороби, тим більше виражені патологічні зміни на МРТ, особливо в базальних структурах головного мозку. У хворих на МРТ, у яких зазначалося витончення мозолистого тіла, були більш виражені когнітивні порушення. Однак достовірної залежності МРТ-даних від форми перебігу ГЦД нам встановити не вдалося. Також не було знайдено залежності між МР-спектроскопічними даними і формою перебігу ГЦД.
Висновки
Структурні зміни в головному мозку хворих ГЦД мають дифузний характер з переважним двостороннім ураженням сірої речовини підкіркових вузлів і стовбура мозку. У меншій мірі уражається біла речовина головного мозку. У всіх хворих в фазі неврологічного прояви хвороби є різного ступеня вираженості атрофічні процеси головного мозку. Таким чином, МРТ-дослідження показує, що у хворих ГЦД розвивається свого роду мультисистемная атрофія головного мозку. Прогресування цього процесу при тривалому перебігу хвороби і застосування терапії хелатами міді можуть вказувати на включення в патогенез дегенерації і таких факторів, як судинне і токсичну впливу купреніла.
МРТ дозволяє підвищити точність диференційної діагностики ГЦД і визначати ефективність проведеної хелаторной терапії.
МР-спектроскопія дає можливість оцінити стан метаболізму в різних структурах головного мозку хворих ГЦД і ступінь розвитку дегенеративного процесу за даними нейронального маркера (NAA) і маркера клітинних мембран (Cho).
список літератури
1. Залялова З.А., Богданов Е.І. Клініко-МРТ аналіз різних варіантів хвороби Коновалова - Вільсона / З.А. Залялова, Е.І. Богданов // Неврол. Вісн. - 2002. - Т. XXXIV, вип. 1-2. - С. 5-10.
2. Звершхановській Ф.А., Галан А.І., Проць О.Б. Хвороба Вільсона - Коновалова. Клінічне спостереження // Медицина транспорту України. -2006. - № 1 (17). - С. 84-87.
3. Коновалов Н.В. Гепатоцеребральная дистрофія. - М .: Медицина, 1960. - 555 с.
4. Крайнова Т.А., Єфремова Л.М. Церулоплазмін. Біологічні властивості та клінічне застосування. - Нижній Новгород: НГМА, 2000. - 31 с.
5. Лекарь П.Г., Макарова В.А. Гепатоцеребральная дистрофія. - Ленінград: Медицина, 1984. - С. 206.
6. Мироненко Т.В., Добрин Б.Ю., Рикова Н.Б. та ін. Сомато-неврологічний синдром. Клініка, діагностика, лікування. - Луганськ, 2010. - 271 с.
7. Пономарьов В.В. Хвороба Вільсона - Коновалова: «великий хамелеон» // Міжнародний неврологічний журнал. - 2010. - Т. 3 (33). - С. 10-15.
8. Рибак Н.В., Кузик Ю.І., Паєнок А.В. Гепатолентикулярной дегенерація (хвороба Коновалова - Вільсона): клініко-патоморфологічній аналіз / Інститут КЛІНІЧНОЇ патології Львівського національного медичного університету імені Данила Галицького // МЛ. - № 3 (79). - 2011 року.
9. Сухарева Г.В. Гепатолентикулярна дегенерація // Вибрані глави клінічної гастроентерології. - М., 2005. - С. 199-209.
10. Труфанов Е.А., Пеннер В.А., Міщенко М.В., Ломова І.В. Клінічний випадок хвороби Коновалова - Вільсона: труднощі діагностики // Український медичний альманах. - 2012. - Т. 15, № 5 (додаток). - С. 460-462.
11. Шток В.Н. Екстрапірамідні розлади: Керівництво по діагностиці та лікуванню / Под ред. В.Н. Штока, І.А. Іванової-Смоленської, О.С. Левіна. - М .: МЕДпресс-інформ, 2002.
12. Щербініна М.Б., Дмитренко Л.П. Хвороба Вільсона - Коновалова: своєчасна діагностика означає життя // Здоров'я України. - 2009. - № 21/1. - С. 40-41.
13. Agudo J., Valdos M., Acosta V. et al. Clinical presentation, diagnosis and long-term outcome of 29 patients with Wilson's disease // Rev. Esp. Enferm. Dig. - 2008. - Vol. 100, № 8. - P. 456-461.
14. Alanen A., Komu M., Penttinen M. Leino R. Magnetic resonance imaging and proton MR spectroscopy in Wilson's disease // Br. J. Radiol. - 1999. - 72. - 749-756.
15. Benhamla T., Tirouche YD, Abaoub-Germain A., Theodore F. The onset of psychiatric disorders and Wilson's disease // Encephale. - 2007. - 33 (6). - 924-32.
16. Choi CG, Ko TS, Lee JH, Suh DC Localized proton MR spectroscopy of the allocortex and isocortex in healthy children // AJNR. - 2000. - 21. - 1354-1358.
17. Danielsen ER, Ross BD Woodhouse A. Magnetic resonance spectroscopy. Activation of neurotransplants in humans // Exp. Neurol. - 1 999.
18. Das SK, Ray K. Wilson's disease: an update // Nat. Clin. Pract. Neurol. - 2006. - 2. - 482-493.
19. Forbes GR, His JR, Cox DW Role of the copper-binding dormain in the copper transport function of ATP7B, the P-type ATPase defective in Wilson disease // J. Biol. Chem. - 1999. - 274.
20. Jayasundar R., Sahani AK, Gaikwad S., Singh S., Behari M. Proton MR spectroscopy of basal ganglia in Wilson's disease: case report and review of literature // Magn. Reson. Imaging. - 2002. - 20. - 131-135.
21. John Wiley et al. Cognitive impairment and magnetic resonance imaging. - 2012.
22. Kaladjian A., Mazzola-Pomietto P., Jeanningros R. Beha-vioral and psychiatric abnormalities in Wilson's disease // Neuroradiology. - 2006. - 48. - 613-621.
23. Kim TJ et al. MR imaging of the brain in Wilson disease of Childhood: findings before and after treatment with clinical correlation // Am. J. Neuroradiol. - 2006. - № 27. - 1373-78.
24. King AD, Walshe JM, Kendall BE, Chinn RJ, Paley MN, Wilkinson ID et al. Cranial MR changes in Wilson's disease // Am. J. Roentgenol. - 1996. - 167. - 1579-84.
25. Kozic D., Svetel M., Petrovic В., Dragasevic N., Semnic R., Kostic VS MR imaging of the brain in patients with hepatic form of Wilson's disease // Eur. J. Neurol. -2003 Sep. - Vol. 10, № 5. - P. 587-92.
26. Kraft E., Trenkwalder C., Then Bergh F., Auer DP Magnetic resonance proton spectroscopy of the brain in Wilson's disease // J. Neurol. - 1999. - 246. - 693-699.
27. Kreyman В., Seige M., Schweigart U. et al. Albumin dialysis: effective removal of copper in patient with fulminant Wilson disease and successful bridging to liver transplantation: a new possibility for the elimination of protein -bound toxins // J. Hepatol. - 1999. -31 (6).
28. Leandro T., Lucato LT, Otaduy MC, Barbosa ER, Machado AA Proton MR spectroscopy in Wilson disease: analysis of 36 cases // AJNR. - 2005 May. - 26 (5). - 1066-71.
29. Maria Chiara Ricciardi, Gaia Sirimarco et al. Transcranial Sonographic findings in Wilson disease // J. Ultrasound Med. - 2010. - 29. - 1143-1145.
30. Martin Südmeyer, Andreas Saleh, Lars Wojtecki et al. Wilson's disease tremor is associated with magnetic resonance imaging lesions in basal ganglia structures // Movement disorders: official journal of the Movement Disorder Society. - 2006. - 21 (12). - 2134-9.
31. Mueller A., Reuner U., Landis B. et al. Extrapyramidal symptoms in Wilson's disease are associated with olfactory dysfunction // Movement disorders society. - 2006.
32. Nazer H., Brismar J., Al-Kawi MZ, Gunasekaran TS, Jorulf KH Magnetic resonance imaging of the brain in Wilson's disease // Neuroradiology. - 1993. - 35. - 130-3.
33. Page RA, Davie CA, MacManus D., Miszkiel KA, Walshe JM, Miller DH et al. Clinical correlation of brain MRI and MRS abnormalities in patients with Wilson disease // Neuro-logy. - 2004. - 63. - 638-43.
34. Prashanth LK et al. Prognostic factors in patients presen-ting with severe neurological forms of Wilson's disease // QJM. - 2005. - 98. - 557-563.
35. Shanmugiah A., Sinha S., Taly AB et al. Psychiatric manifestations in Wilson's disease: a cross-sectional analysis // J. Neuropsychiatry Clin. Neurosci. - 2008. - 20 (1). - 81-5.
36. Sinha S., Taly AB, Prashanth LK et al. Sequential MRI changes in Wilson's disease with de-coppering therapy // The British J. Radiology. - 2006. - 744-748.
37. Trocello JM Wilson France: a national database for Wilson's disease // Orphanet J. Rare Dis. - 2010. - 5 (Suppl. 1). - P. 21.
38. Tsivkovskii R., Eisses JF, Kaplan JH, Lutsenko S. Functional properties of the copper-transporting ATPase ATP7B (the Wilson's disease protein) expressed in insect cells // J. of Biol. Chem. - 2002. - Vol. 277, № 2. - P. 976-983.
39. Van den Heuvel AG, Van der Grond J., Van Rooij LG et al. Differentiation between portal-systemic encephalopathy and neurodegenerative disorders in patients with Wilson disease: Hl MR spectroscopy // Radiology. - 1997. - 203. - 539-543.
40. Walter U., Krolikowski K., Tarnacka B., Benecke R., Czlonkowska A., Dressier D. Sonographic detection of basal ganglia lesions in asymptomatic and symptomatic Wilson disease // Neuro-logy. - 2005. - 64. - 1726-1732.
41. Walter U., Behnke S., Eyding J. et al. Transcranial brain parenchyma sonography in movement disorders: state of the art // Ultrasound Med. Biol. - 2007. - 33. - 15-25.

