open wikipedia design.
ацетон 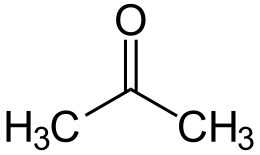
 загальні систематичне
загальні систематичне
найменування пропан-2-он Традиційні назви ацетон, диметилкетон Хім. формула C3H6O Рац. формула CH3-C (O) -CH3 Фізичні властивості стан рідина молярна маса 58,08 г / моль щільність 0,7899 г / см³ енергія іонізації 9,69 ± 0,01 еВ [1] термічні властивості Т. плав. -95 ° C Т. кип. 56,1 ° C Т. доп. -20 ° C Т. свспл. 465 ± 1 ° C [2] Пр. взрв. 2,5 ± 0,1 об.% [1] Кр. крапка 235,5 ° C; 4.7МПа ентальпія освіти -216,5 кДж / моль ентальпія плавлення 5,69 кДж / моль Тиск пара 180 ± 1 мм рт.ст. [1] Хімічні властивості pKa 19,16 ± 0,04 [3] Оптичні властивості Показник заломлення 1,3588 Класифікація Реєстр. номер CAS 67-64-1 PubChem 180 Реєстр. номер EINECS 200-662-2 SMILES InChI RTECS AL3150000 ChEBI 15347 і 40571 номер ООН 1090 ChemSpider 175 Безпека ЛД50 1159 мг / кг токсичність  Наводяться дані для стандартних умов (25 ° C, 100 кПа) , Якщо не вказано іншого.
Наводяться дані для стандартних умов (25 ° C, 100 кПа) , Якщо не вказано іншого.
Ацетон (диметилкетон, пропанон-2) [4] - органічна речовина , що має формулу CH3-C (O) -CH3, найпростіший представник насичених кетонів .
Свою назву ацетон отримав від лат. acetum - оцет . Це пов'язано з тим, що раніше ацетон отримували з ацетатов , А з самого ацетону отримували синтетичну крижану оцтову кислоту . В 1848 році німецький професор медицини і хімії Леопольд Гмелін ввів термін в офіційне вживання [5] [6] , Використавши старе німецьке слово Aketon (кетон, ацетон), яке також бере коріння від латинського acetum.
Один з найпростіших і в той же час найважливіших з кетонів - ацетон - вперше виявлено в 1595 році німецьким хіміком Андреасом Лібаво в процесі сухої перегонки ацетату свинцю . Однак точно визначити його природу і хімічний склад вдалося тільки в 1832 році Жану-Батісту Дюма і Юстус фон Лібіху . До 1914 року ацетон отримували практично виключно коксуванням деревини , Однак підвищений попит на нього в роки Першої світової війни дуже швидко стимулював створення нових методів виробництва.
Ацетон - безбарвна рухома летюча рідина (при н.у. ) З характерним різким запахом . У всіх співвідношеннях змішується з водою , діетиловим ефіром , бензолом , метанолом , етанолом , багатьма складними ефірами і так далі.
Основні термодинамічні властивості ацетону: [7]
- Поверхневий натяг (20 ° C): 23,7 мН / м
- Стандартна ентальпія утворення ΔH (298 К): -247,7 кДж / моль (ж)
- Стандартна ентропія освіти S (298 К): 200 Дж / моль · K (ж)
- Стандартна мольна теплоємність Cp (298 К): 125 Дж / моль · K (ж)
- Ентальпія плавлення ΔHпл: 5,69 кДж / моль
- Ентальпія кипіння ΔHкіп: 29,1 кДж / моль
- Теплота згоряння Qp: 1829,4 кДж / моль
- Критичний тиск: 4,7 МПа
- Критична щільність: 0,273 г / см3
- Динамічна в'язкість рідин і газів:
- 0,36 мПа · с (10 ° C)
- 0,295 мПа · с (25 ° C)
- 0,28 мПа · с (41 ° C)
Термохімічні властивості:
- Температура спалаху в повітрі [8] : (-20 ° C) [4]
- Температура самозаймання на повітрі [8] [7] : 465 ° C
- Межі вибухонебезпечних концентрацій [8] : 2,6-12,8%
Оптичні властивості:
- Показник заломлення (для D-лінії натрію):
- 1,3591 (20 ° C)
- 1,3588 (25 ° C)
- Показник дисоціації: pKa = 20 (20 ° C, вода)
- Діелектрична проникність (20 ° C): 20,9
- Дипольний момент молекули (20 ° C): 2,84 Дебай
Ацетон добре розчиняє багато органічні речовини , зокрема, ацетил і нітроцелюлози , воски , алкалоїди і так далі, а також ряд солей .
Ацетон утворюється при ацетонове (ацетон-бутиловом) бродінні вуглеводів , Що викликається Clostridium acetobutylicus . В результаті утворюється ацетон і бутанол-1 , А також ряд побічних домішок. В якості промислового такий метод отримання ацетону був популярний в XIX - початку XX ст., але був витіснений технологіями хімічного синтезу .
Ацетон є одним з найбільш реакційноздатних кетонів . Так, він один з небагатьох кетонів утворює бісульфітне з'єднання:
(CH 3) 2 CO + N a HSO 3 ⟶ (CH 3) 2 C (OH) SO 3 N a {\ displaystyle {\ mathsf {(CH_ {3}) _ {2} CO + NaHSO_ {3} \ longrightarrow (CH_ {3}) _ {2} C (OH) SO_ {3} Na}}}
Під дією лугів вступає в альдольної самоконденсаціі, з утворенням діацетонового спирту:
2 (CH 3) 2 CO → OH - (CH 3) 2 C (OH) CH 2 C (O) CH 3 {\ displaystyle {\ mathsf {2 (CH_ {3}) _ {2} CO {\ xrightarrow { OH ^ {-}}} (CH_ {3}) _ {2} C (OH) CH_ {2} C (O) CH_ {3}}}}
відновлюється цинком до пінакон :
2 (CH 3) 2 CO → Z n (CH 3) 2 C (OH) C (OH) (CH 3) 2 {\ displaystyle {\ mathsf {2 (CH_ {3}) _ {2} CO {\ xrightarrow {Zn}} (CH_ {3}) _ {2} C (OH) C (OH) (CH_ {3}) _ {2}}}}
При піролізі (700 ° C) утворює кетен :
(CH 3) 2 CO ⟶ CH 2 = C = O + CH 4 {\ displaystyle {\ mathsf {(CH_ {3}) _ {2} CO \ longrightarrow CH_ {2} {\ text {=}} C {\ text {=}} O + CH_ {4}}}}
легко приєднує ціановодород з освітою ацетонциангидріна :
(CH 3) 2 CO + HCN ⟶ (CH 3) 2 C (OH) CN {\ displaystyle {\ mathsf {(CH_ {3}) _ {2} CO + HCN \ longrightarrow (CH_ {3}) _ {2 } C (OH) CN}}}
атоми водню в ацетоні легко заміщуються на галогени . Під дією хлору ( йоду ) В присутності лугу утворює хлороформ ( йодоформ ).
Hal 2 + 2 NaOH ⟶ NaHal + NaOHal + H 2 O {\ displaystyle {\ ce {Hal2 + 2NaOH -> NaHal + NaOHal + H2O}}}
(CH 3) 2 CO + 3 NaOHal ⟶ CH 3 - CO - CHal 3 + 3 NaOH {\ displaystyle {\ ce {(CH3) 2CO + 3NaOHal -> CH3-CO-CHal3 + 3NaOH}}}
CH 3 - CO - CHal 3 + NaOH ⟶ CHHal 3 ↓ + CH 3 COONa {\ displaystyle {\ ce {CH3-CO-CHal3 + NaOH-> CHHal3 \ downarrow + CH3COONa}}}
Якісною реакцією на диметилкетон є наявність інтенсивно-червоного забарвлення з нітропрусидом натрію в лужному середовищі. При додаванні CH3COOH забарвлення переходить в червоно-фіолетову.
(CH 3) 2 CO + Na 2 [Fe (CN) 5 NO] + 2 NaOH ⟶ Na 4 [Fe (CN) 5 ON = CHCOCH 3] + 2 H 2 O {\ displaystyle {\ ce {(CH3) 2CO + Na2 [Fe (CN) 5NO] + 2NaOH -> Na4 [Fe (CN) 5ON = CHCOCH3] + 2H2O}}}
Світове виробництво ацетону становить понад 6,9 мільйона тонн на рік (за даними на 2012 р [9] .) І стійко зростає [9] .
У промисловості виходить безпосередньо або побічно з пропена .
кумольним спосіб
Основну частину ацетону отримують як сопродукт при отриманні фенолу з бензолу по кумольним способу. Процес протікає в 3 стадії. [10]
На першій стадії бензол алкілуючі пропеніл з отриманням кумола , На другий і третій ( реакція Удріс - Сергєєва ) Отриманий кумол окислюється киснем повітря до гідропероксиду , Який при дії сірчаної кислоти розкладається на фенол і ацетон:
C 6 H 6 + CH 3 CH = CH 2 ⟶ C 6 H 5 CH (CH 3) 2 {\ displaystyle {\ mathsf {C_ {6} H_ {6} + CH_ {3} CH {\ text {=}} CH_ {2} \ longrightarrow C_ {6} H_ {5} CH (CH_ {3}) _ {2}}}} C 6 H 5 CH (CH 3) 2 + O 2 ⟶ C 6 H 5 C (OOH) (CH 3) 2 {\ displaystyle {\ mathsf {C_ {6} H_ {5} CH (CH_ {3}) _ {2} + O_ {2} \ longrightarrow C_ {6} H_ {5} C (OOH) (CH_ {3}) _ {2}}}}
C 6 H 5 C (OOH) (CH 3) 2 ⟶ C 6 H 5 OH + (CH 3) 2 CO {\ displaystyle {\ mathsf {C_ {6} H_ {5} C (OOH) (CH_ {3} ) _ {2} \ longrightarrow C_ {6} H_ {5} OH + (CH_ {3}) _ {2} CO}}}
з изопропанола
За даним методом изопропанол окислюють в паровій фазі при температурах 450-650 ° C на каталізаторі (металеві мідь , срібло , нікель , платина ). Ацетон з високим виходом (до 90%) отримують на каталізаторі «срібло на пемзі» або на срібній сітці:
(CH 3) 2 CH - OH + O 2 ⟶ (CH 3) 2 CO + H 2 O 2 {\ displaystyle {\ mathsf {(CH_ {3}) _ {2} CH {\ text {-}} OH + O_ {2} \ longrightarrow (CH_ {3}) _ {2} CO + H_ {2} O_ {2}}}} Метод окислення пропена
Ацетон отримують також прямим окисленням пропена в рідкій фазі в присутності PdCl2 в середовищі розчинів солей Pd , Cu , Fe при температурі 50-120 ° C і тиску 50-100 атм :
CH 3 CH = CH 2 + P d C l 2 + H 2 O ⟶ (CH 3) 2 CO + P d + 2 HC l {\ displaystyle {\ mathsf {CH_ {3} CH {\ text {=}} CH_ {2} + PdCl_ {2} + H_ {2} O \ longrightarrow (CH_ {3}) _ {2} CO + Pd + 2HCl}}} 2 P d + 4 HC l + O 2 ⟶ 2 P d C l 2 + 2 H 2 O {\ displaystyle {\ mathsf {2Pd + 4HCl + O_ {2} \ longrightarrow 2PdCl_ {2} + 2H_ {2} O} }}
Деяке значення має метод бродіння крохмалю під дією бактерій Clostridium acetobutylicum з утворенням ацетону і бутанола [11] . Метод характеризується малими виходами. Використовуються також методи отримання з ізопропілового спирту і ацетилену .
Ацетон застосовується як сировина для синтезу багатьох важливих хімічних продуктів, таких як оцтовий ангідрид , кетен , діацетоновий спирт , окис мезітіла , метилізобутилкетон , метилметакрилат , діфенілпропана , ізофорон , бісфенол А і так далі; приклад:
(CH 3) 2 CO + 2 C 6 H 5 OH ⟶ (CH 3) 2 C (C 6 H 4 OH) 2 {\ displaystyle {\ mathsf {(CH_ {3}) _ {2} CO + 2C_ {6 } H_ {5} OH \ longrightarrow (CH_ {3}) _ {2} C (C_ {6} H_ {4} OH) _ {2}}}}
Останній широко застосовується при синтезі поликарбонатов , поліуретанів і епоксидних смол .
Ацетон також є популярним розчинником . Зокрема він використовується як розчинник
Без ацетону неможливо зберігати в компактному (зрідженому і в балоні) стані ацетилен , Який під тиском в чистому вигляді вкрай вибухонебезпечний. Для цього використовують ємності з пористим матеріалом, просоченим ацетоном. 1 літр ацетону розчиняє до 250 літрів ацетилену.
Ацетон використовується також при екстракції багатьох рослинних речовин.
Лабораторне застосування [ правити | правити код ]
У органічної хімії ацетон застосовується в якості полярного апротонного розчинника , Зокрема, в реакції алкилирования
A r OH + RC l + K 2 CO 3 ⟶ A r OR + KC l + KHCO 3 {\ displaystyle {\ mathsf {ArOH + RCl + K_ {2} CO_ {3} \ longrightarrow ArOR + KCl + KHCO_ {3} }}}
для окислення спиртів в присутності алкоголятов алюмінію по Оппенауеру
RR 'CH - OH + (CH 3) 2 CO ⟶ RR' CO + (CH 3) 2 CH - OH {\ displaystyle {\ mathsf {RR'CH {\ text {-}} OH + (CH_ {3}) _ {2} CO \ longrightarrow RR'CO + (CH_ {3}) _ {2} CH {\ text {-}} OH}}}
Ацетон застосовується для приготування охолоджуючих лазень в суміші з «Сухим льодом» і рідким аміаком (Охолоджує до температури -78 ° C).
У лабораторіях використовується для миття хімічного посуду завдяки низькій ціні, малої токсичності, високої летючості і легкої розчинності в воді, а також для швидкого сушіння посуду і неорганічних речовин.
Для очищення в лабораторних умовах ацетон переганяють в присутності невеликої кількості перманганату калію (до слабо-рожевого забарвлення розчину).
В хіміко-токсикологічному аналізі для виявлення ацетону застосовують реакції з розчинами йоду , Нитропруссида натрію, фурфуролу , Ο - нітробензальдегіда і метод мікродифузії.
Реакція на освіту йодоформу [13] .
При взаємодії ацетону з розчином йоду в лужному середовищі утворюється трііодметан (йодоформ):
I 2 + 2 OH - ⟶ IO - + I - + H 2 O {\ displaystyle {\ mathsf {\ I_ {2} + 2OH ^ {-} \ longrightarrow \ IO ^ {-} + I ^ {-} + H_ {2} O}}} 3 IO - + CH 3 COCH 3 ⟶ I 3 C - COCH 3 + 3 OH - {\ displaystyle {\ mathsf {\ 3IO ^ {-} + CH_ {3} COCH_ {3} \ longrightarrow \ I_ {3} C {\ text {-}} CO {\ text {-}} CH_ {3} + 3OH ^ {-}}}}
I 3 C - CO - CH 3 + OH - ⟶ CHI 3 + CH 3 COO - {\ displaystyle {\ mathsf {\ I_ {3} C {\ text {-}} CO {\ text {-}} CH_ {3 } + OH ^ {-} \ longrightarrow \ CHI_ {3} + CH_ {3} COO ^ {-}}}}
До 1 мл досліджуваного розчину додають 1 мл 10% -го розчину аміаку і кілька крапель розчину йоду в йодиді калію (Йодної настоянки). У присутності йоду утворюється жовтий осад трііодметана з характерним запахом, а його кристали мають характерну гексалучевую форму. Межа виявлення - 0,1 мг ацетону в пробі.
Реакція з нітропрусидом натрію (проба легальний) [13] [14] .
ацетон з нитропруссидом натрію в лужному середовищі дає інтенсивно-червоне забарвлення. При підкисленні оцтовою кислотою забарвлення переходить в червоно-фіолетову. Кетони, в молекулах яких відсутні метильние групи , Безпосередньо пов'язані з кетоновими (СО) групами, не дають такої реакції. Відповідно такі кетони як метилетилкетон , метілпропілкетон та інші - також дадуть червоне забарвлення з нітропрусидом.
CH 3 COCH 3 + N a 2 [F e (CN) 5 NO] + 2 N a OH ⟶ N a 4 [F e (CN) 5 ON = CHCOCH 3] + 2 H 2 O {\ displaystyle {\ mathsf { \ CH_ {3} COCH_ {3} + Na_ {2} [Fe (CN) _ {5} NO] + 2NaOH \ longrightarrow \ Na_ {4} [Fe (CN) _ {5} ON {\ text {=} } CHCOCH_ {3}] + 2H_ {2} O}}}
До 1 мл досліджуваного розчину додають 1 мл 10% -го розчину гідроксиду натрію і 5 крапель 1% -го свіжоприготовленого розчину нитропруссида натрію . При наявності ацетону в пробі з'являється червона або оранжево-червоне забарвлення. При додаванні 10% -го розчину оцтової кислоти до кислої реакції через кілька хвилин забарвлення переходить в червоно-фіолетову або вишнево-червону. Слід зауважити, що бутанон дає аналогічну забарвлення з нітропрусидом натрію.
Одна з основних небезпек при роботі з ацетоном - його Легкозаймистість. температура самозаймання +465 ° C, Температура спалаху -20 ° C. Повітряні суміші, що містять від 2,5% до 12,8% (за обсягом), вибухонебезпечні. З цим необхідно рахуватися, так як ацетон швидко випаровується, і утворюється хмара може поширитися до місця займання (нагрів або іскра) далеко від місця роботи з ним.
Ацетон є природним метаболитом , Виробленим організмами ссавців , В тому числі і людським організмом. Деяка кількість речовини виводиться з повітрям, що видихається і виділеннями шкіри, деякий - з сечею. У медицині ацетон відносять до кетонові тіл . Порушення нормального метаболізму, наприклад, при цукровому діабеті, призводить до так званої ацетонурії - надмірному утворенню і виведенню ацетону.
У крові в нормі міститься 1-2 мг / 100 мл ацетону, в добовій кількості сечі - 0,01-0,03 г. При порушеннях обміну речовин, наприклад, при цукровому діабеті , В сечі і крові підвищується вміст ацетону. Незначна частина ацетону перетворюється в оксид вуглецю (IV) , Який виділяється з повітрям, що видихається. Деяка кількість ацетону виділяється з організму в незмінному вигляді з повітрям, що видихається і через шкіру, а деякий - з сечею.
Ацетон отруйний, але відноситься до малонебезпечних речовин ( клас небезпеки IV, категорія безпеки для здоров'я по NFPA - 1). Сильно дратує слизисті оболонки: тривале вдихання високих концентрацій парів призводить до виникнення запалення слизових оболонок , набряку легенів і токсичної пневмонії . Пари чинять слабкий наркотичну дію , Супроводжуване, найчастіше, дисфорией . При попаданні всередину викликає стан сп'яніння , Супроводжуване слабкістю і запамороченням, нерідко - болями в животі ; в істотних кількостях виникає виражена інтоксикація , Хоча, як правило, отруєння ацетоном не смертельні. можливе ураження печінки (токсичний гепатит ), нирок (зменшення діурезу , Поява крові і білка в сечі) і коматозний стан . при інгаляційному впливі ацетон виводиться набагато повільніше (протягом декількох годин), ніж надходить, і тому може накопичуватися в організмі.
Ацетон, в концентрації більше 60%, в Росії входить в таблицю III спіcка IV « Переліку наркотичних засобів, психотропних речовин та їх прекурсорів »І його оборот підлягає контролю. При роботі в лабораторії з ацетоном, операції по його витраті повинні вноситися до спеціального журналу: журнал реєстрації операцій, при яких змінюється кількість прекурсорів наркотичних засобів і психотропних речовин.
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0004.html
- ↑ http://www.cdc.gov/niosh/ipcsneng/neng0087.html
- ↑ Chiang Y., A. Jerry Kresge, Tang YS et al. The pKa and keto-enol equilibrium constant of acetone in aqueous solution // J. Am. Chem. Soc. / PJ Stang - American Chemical Society , 1984. - Vol. 106, Iss. 2. - P. 460-462. - ISSN 0002-7863 ; 1520-5126 ; 1943-2984 - doi: 10.1021 / JA00314A055
- ↑ 1 2 Хімічна енциклопедія. - М: Радянська енциклопедія, 1988. - Т. 1. - С. 230. - 625 с.
- ↑ Контроль бета-кетонів (неопр.).
- ↑ Ацетон (кетонові тіла) в сечі (неопр.).
- ↑ 1 2 Рабинович В. А., Хавін З. Я. Короткий хімічний довідник: Справ. изд. / Под ред. Потєхіна А. А., Єфімова А. І .. - Видання 3-тє, перероблене і доповнене. - Л. :: Хімія, 1991. - С. 328-329. - 432 с. - ISBN 5-7245-0703-X .
- ↑ 1 2 3 Lewis RJ Sax's Dangerous Properties of Industrial Materials . - 11ed .. - Wiley-interscience, 2004. - С. 22-23.
- ↑ 1 2 http://www.newchemistry.ru/printletter.php?n_id=4886 ВИРОБНИЦТВО АЦЕТОНУ: отримання, застосування, ринок за даними АКПР (Академії кон'юнктури промислових ринків)
- ↑ Хімічна енциклопедія. М. 1988, Т1, стор. 230
- ↑ http://kodomo.cmm.msu.ru/~ramil.mintaev/projects/C.acetobutylicum/index.php Аціто-бутанова бактерія
- ↑ Ацетон // Фотокинотехника: Енциклопедія / Гол. ред. Е. А. Іофіс . - М.: Радянська енциклопедія , 1981. - 447 с.
- ↑ 1 2 Крамаренко В. Ф. Токсикологічна хімія. - К.: Вища шк. Головне вид-во, 1989. - С. 146-149. - 447 с. - ISBN 5-11-000148-0 .
- ↑ легальний проба (неопр.).

