Характеристика вірусних патогенезу мишей
Патогенез IAV пов'язано з захворюваності і смертності, спричинених його інфекції. Ці два параметри можуть оцінюватися в мишей легко: IAV захворюваності пов'язано з втратою ваги тіла в заражених мишей і відсоток виживання буде вказувати рівень смертності (рис. 1). Ваги тіла і виживання в IAV-інфікованих мишей зазвичай контролюються щодня, принаймні два тижні після зараженія8,9,10,29. Отримані дані виживання може визначити MLD50, яка була розрахована з використанням методу Рід і Мюнх25. Ще одним показником IAV патогенез пов'язаний з вірусної реплікації в нижньому (легкі) і верхню (слизової оболонки носа) дихальних шляхів (рис. 1). Інформація, отримана з вірусною титр в цих органах відповідає захворюваності і смертності значення і в сукупності забезпечують хороше уявлення про патогенез вірусної. Відомо, що IAV реплікації в легені миші піку між 2 і 4 днів після інфекції (ПЗ), і тому рекомендується відновлення цих органів в дні 2 і 4 П.І.
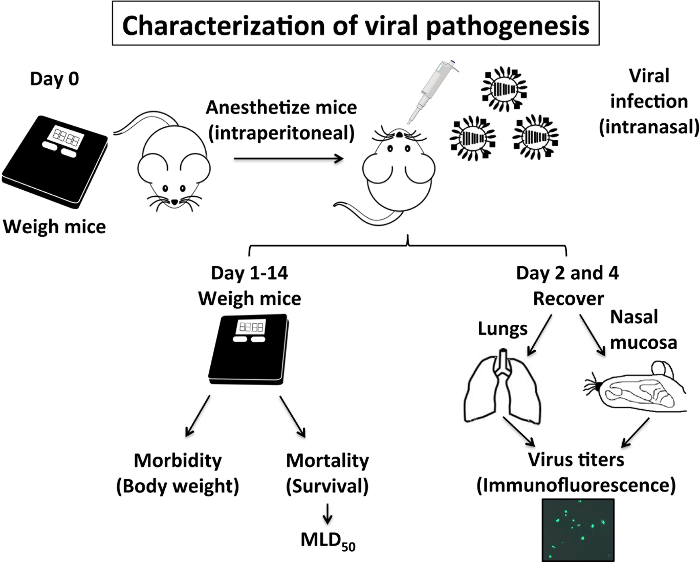
Малюнок 1: характеристика патогенезу IAV мишей: Патогенез IAV мишей пов'язана його захворюваності (втрата маси тіла) і смертності (виживання%), а також IAV можливість реплицировать у верхній (слизової оболонки носа) і нижніх дихальних шляхів (легкі). Коротенько в день 0 зважуються і внутрибрюшинно наркозом з 2,2,2-tribromoethanol (КЕ), перш ніж вони интраназально заражені IAV мишей. Від 1 дня до 14 день мишей зважують щодня оцінювати втрата маси тіла (захворюваності) і% виживання (смертність) для обчислення миші летальна доза 50 (50MLD). На дні, 2 і 4 день після інфекції відновлені і гомогенізовані для оцінки вірусної реплікації мишей легких і слизової оболонки носа. Мишей характеризувати IAV патогенезу, використовуючи PR8 WT є експерименти в умовах BSL-2. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.
В Малюнок 2 представлені дані, отримані в ході оцінки патогенезу PR8 WT. Чотири групи по 6-у-8-week-old мишей C57BL / 6 (n = 11) були заражених І.М. з вказаної дози (10, 102, 103 і 104 ФФУ / миша) від PR8 WT. Ваги тіла і виживання 5 мишей кожної групи були виміряні за 14 днів П.І. (Малюнок 2A - B). Все мишей імунізованих з 104 ФФУ PR8 WT втратив вагу швидко (малюнок 2A) і все з них помер у дні 5 і 6 П.І. (Рис. 2B). Мишей імунізованих з 103 ФФУ PR8 WT втратив вагу тіла в пізній час П.І. (Малюнок 2A) і вони всі померли П.І. днів 7 і 8 (рис. 2B). Все мишей імунізованих з 102 ФФУ PR8 WT втратив вагу тіла (малюнок 2A) але тільки 2 з них помер у день 9 П.І. (Малюнок 2Б). Нарешті мишей імунізованих з 10 ФФУ PR8 WT не втрачати вагу (малюнок 2A), і все з них вижили інфекції (рис. 2B). MLD50 PR8 WT в цьому експерименті, розрахованими Рід і Мюнх метод25 був 1,5 х 102 ФФУ (рис. 2 c).
Оцінити PR8 реплікації у верхній і нижче дихальних шляхів мишей, інфікованих І.М. з вказаної дози (10, 102, сто третьому 104 ФФУ / миша), легких і слизової оболонки носа були знайдені на дні, 2 і 4 П.І. (N = 3). Після гомогенізації легких кількість вірусу в цей орган був проаналізований пробірного імунофлюоресценції (Малюнок 2D). Вірусна титр, виявлених в легких мишей різних груп була пов'язана з дози, що використовуються для імунізації їх: вище вірусна титри були виявлені в легенях мишей імунізованих з 10 ФФУ PR8 WT4 днів, 2 і 4 П.І., в той час як нижня вірусний титри були виявлені в легені мишей імунізованих з 10 ФФУ PR8 WT.
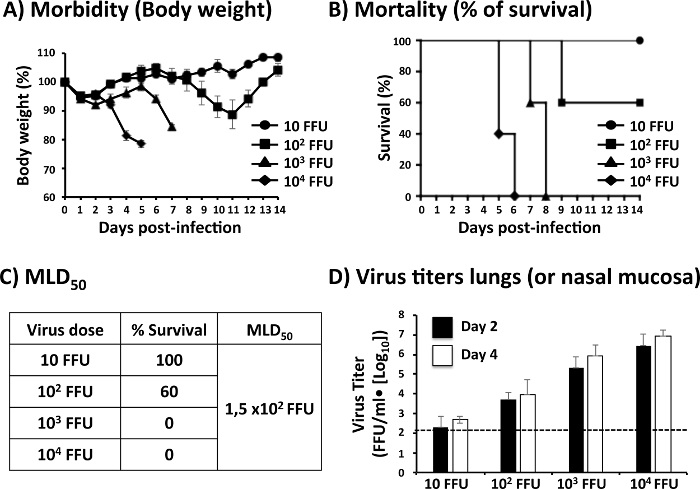
Малюнок 2: представлення даних отриманих в ході оцінки вірусних патогенезу: Для аналізу захворюваності і смертності PR8 WT, 6-в-8-тижневих самок мишей C57BL / 6 (n = 5) були заражених І.М. із зазначеним номером люмінесцентні-формування одиниць (ФФУ) PR8 WT і потім щодня контроль за 2 тижні для втрати ваги тіла (A) (захворюваності) і (B) виживання (смертність). Дані являють собою засоби і стандартні відхилення результатів визначається для окремих мишей (n = 5). (C) значення% виживання, оцінюються більш ніж 2 тижні використовуються для обчислення MLD50 за допомогою методу Рід і Мюнх25. (D) для оцінки вірусної реплікації, 6-в-8-тижневих самок мишей C57BL / 6 (n = 6) були заражених І.М. із зазначеним номером ФФУ. Вірусної реплікації в легких або слизової оболонки носа заражених мишей зазвичай оцінюється П.І. дні, 2 і 4, за допомогою immunofocus assay. Вірусна титри записуються як ФФУ / мл. Дані являють собою засоби і SDs результатів, отриманих в кожній миші. Пунктирні лінії включені вказати межа виявлення (200 ФФУ / мл) assay. Мишей і тканинної культури експериментів для оцінки захворюваності, смертності та вірусних титри за допомогою PR8 IAV проводилися в умовах BSL-2. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.
Оцінка гуморальні відповіді, індукованих після вакцинації
Гуморальні відповіді, індукованої проти IAV інфекції відіграють важливу роль в боротьбі з вірусною інфекцією. З цієї причини дуже важливо для аналізу гуморальні відповіді, викликав IAV WT інфекції або нових IAV вакцин (рис. 3). У моделі миші через 14 днів після імунізації, мишей Блед аналізувати наявність антитіл проти всього вірусні білки, ELISA (рис. 4) і наявність нейтралізуючих антитіл проти вірусного білка HA, який зазвичай проаналізовані загальні серологічні підходи, такі як (пробірного Хайнг клас = "xfig »> рис. 5) і / або вна (рис. 6).
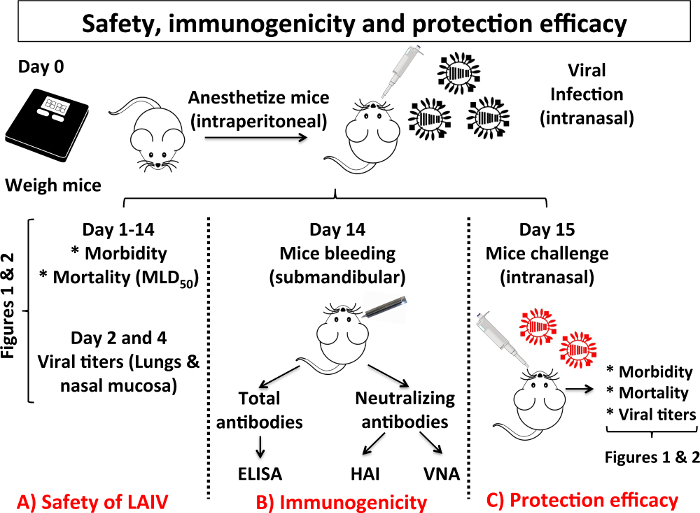
Малюнок 3: схема різних кроків в характеристиці безпеку, імуногенність та ефективність захисту LAIV: Коли розробляється новий LAIV, модель миші IAV інфекції зазвичай використовується для перевірки безпеки, охорони та імуногенності ефективності. У цій схемі, експерименти, щоб оцінити безпеку (A), вказані імуногенності (B) і (C) захисту ефективність кандидата LAIV. (A) для оцінки безпеки LAIV це необхідно для аналізу тих же параметрів (захворюваності, смертності та вірусної реплікації в верхніх і нижніх дихальних шляхів) описані на рис. 1. Для оцінки імуногенність, щеплення мишей і 14 днів після вакцинації вони є Блед, підщелепної прокол. Гуморальні відповіді аналізуються шляхом оцінки присутність всього антитіла проти білків IAV ензим з'єднаний assay імуносорбенту (ELISA) та оцінки присутності нейтралізуючих антитіл пробірного гальмування гемаглютинації (ВЛІ) і / або вірус microneutralization проба (ВНА). (C) для оцінки ефективності захисту, через 15 днів після вакцинації, оскаржуються мишей із захистом масова IAV ефективність оцінюється вимірювання мишей захворюваності, смертності та вірусних титри в легких з оскаржується мишей, як описано в Малюнок 1. Мишей для характеристики безпеки, охорони та імуногенності ефективність LAIV кандидата є експерименти в умовах BSL-2. Інші BSL костюми або стримування умови можуть знадобитися в залежності від штаму IAV, використовується для виклику щеплення мишей. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.
Щоб оцінити імуногенності PR8 LAIV, три групи 6-в-8-week-old мишей C57BL / 6 (n = 5) щеплення були зроблені з різних дозах (102, сто третій 104 ФФУ / миша) PR8 LAIV або макет, щеплення з ПБС як негативний контроль. Чотирнадцять днів після вакцинації, мишей sera були зібрані підщелепної кровотеченія26 (рис. 3). Реакції антитіла проти всього вірусні білки були оцінені ELISA за допомогою розбавлення 1: 200 клітин екстракту MDCK PR8-інфікованих клітин (рис. 4). Кожен сироватка була проаналізована індивідуально. Результати показують, що сироваток від мишей імунізованих з більш високі дози (104 ФФУ) від PR8 LAIV був вище титри антитіл проти всього PR8 білки ніж сірка мишей імунізованих з низькою дози (102 ФФУ). Sera управління (МОК інфікованих мишей) не показують реактивністю проти PR8 антигенів.
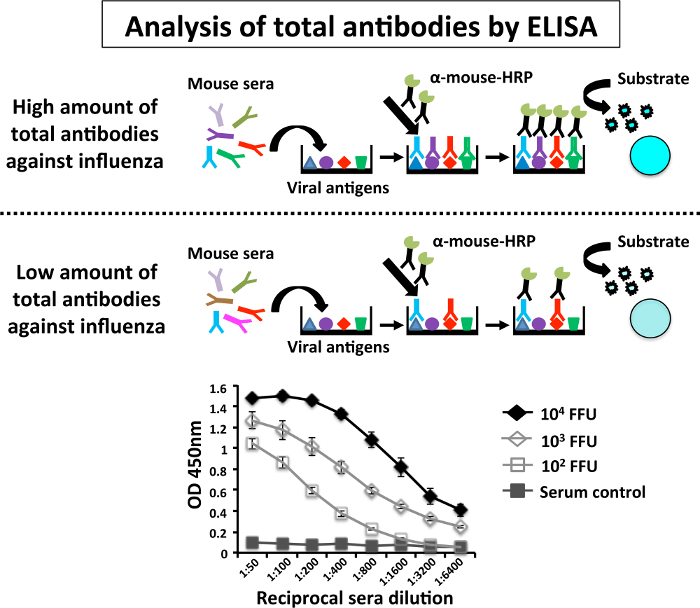
Малюнок 4: Схематичне представлення ензим з'єднаний Assay імуносорбенту (ELISA) для оцінки реакції гуморального антитіла: ELISA визначаються рівні PR8-специфічних антитіл в заражених мишей в 96-ямковий пінополістирольні плити, покриті клітинних екстрактів з макетів (управління) або MDCK PR8-інфікованих клітин. Коротенько на 14 днів П.І. (Рис. 3), мишей імунізованих з вказаної дози PR8 LAIV були Блед, підщелепної прокол і sera були зібрані. Кожен сироватки оцінювалася індивідуально по ELISA для IgG антитіла проти всього PR8 білків. Граф даних являють собою засоби і стандартні відхилення результатів отриманих від індивідуальних мишей сірка (n = 6). О.Д., оптичної щільності. ELISA assays були виконані в кабінеті BSL-2. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.
Щоб проаналізувати наявність нейтралізуючих антитіл в миші сироватки за допомогою Хай пробірного, серійних розведень 2 рази сироваток (раніше інактивована на 56 ° C) кожної групи мишей імунізованих з різними дозами (102, сто третій 104 ФФУ) від PR8 LAIV інкубували з 4 Гау PR8 WT для 1 h на RT (рис. 5). Потім 0,5% еритроцитів Туреччини були додані до суміші PR8-сірка. Верхня частина рисунка 5 це схематичне уявлення можливих результатів Хай: коли сироватка містить нейтралізуючі антитіла, RBCs опадів спостерігається в нижній частині свердловини, тому що антитіла, зобов'язаний вірусного білка HA запобігти hemagglutination еритроцитів. З іншого боку під час відсутності нейтралізують антитіл, спостерігається гемаглютинації еритроцитів. Потім титр Хай розраховується як взаємні розведення сироватки в останній також не вистачає гемаглютинації. Результати Хай, показаний в нижній частині рисунка 5 показують, що сироватка від миші щеплення з найбільшу кількість PR8 LAIV (104 ФФУ) мають високий титр нейтралізуючих антитіл, в той час як сироватки від миші імунізацію з більш низькі дози (102 ФФУ) мають низький титр нейтралізують антитіл проти PR8. Чи не нейтралізуючі антитіла присутні в сироватці крові управління (МОК інфікованих мишей).
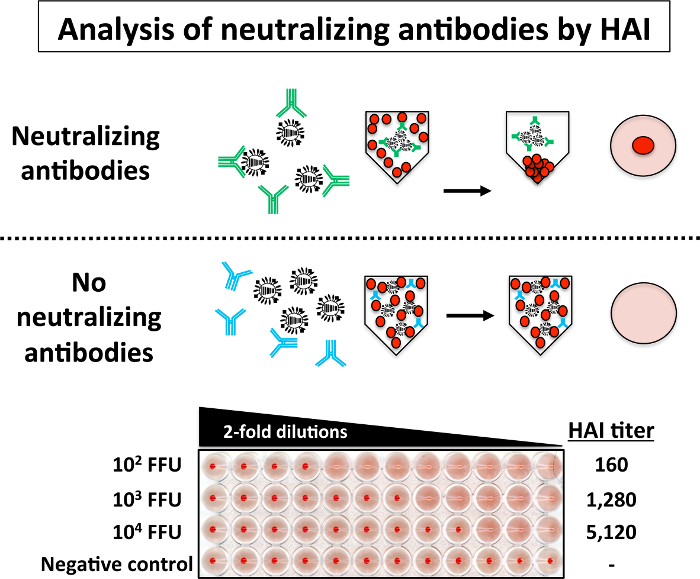
Малюнок 5: Hemagglutination Assay інгібування (HAI): Рівні нейтралізують антитіл проти PR8 WT в заражених мишей може легко бути оцінені Хай пробірного. Коротенько 2 рази серійних розведень (починаючи розведенні 1:10) сироватки від мишей імунізованих з вказаної дози PR8 LAIV були змішані з 4 Гау PR8 WT для 1 h на RT в 96-ямковий V-днище (1: 1). Після інкубації 1 h 0,5% еритроцитів були додані до суміші вірус сироватка для 30-60 хвилин на льоду. Хай титри визначаються шляхом виявлення останнього добре в якому RBCs формують червону кнопку і гемаглютинації не відбувається (вгорі). Хай аналізів з PR8 WT були виконані в кабінеті BSL-2. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.
На малюнку 6 представлені дані, отримані в ході оцінки нейтралізують антитіл в сироватці миші ВНА. 200 ФФУ PR8 WT були змішані з послідовним 2 рази розведення сироваток (раніше inactivatЕд на 56 ° C) від мишей імунізованих з різними дозами (102, сто третій 104 ФФУ) від PR8 LAIV за 1 годину на RT. Кожен зразок сироватки оцінювалася в трьох примірниках. Вірус сірка суміші були використані для заразити моношарів MDCK клітин в 96-ямковий пластині. Верхня частина рис. 6 це схематичне уявлення можливих результатів ВНА: відсутність нейтралізують антитіл в сироватці крові призводить до CPE на приблизно 3-4 дня П.І. На відміну від цього, коли присутні нейтралізуючі антитіла (недоторканими клітини одношарова), вони зв'язати вірусний HA і запобігти вірусній інфекції, і немає ніяких CPE. Присутність CPE зазвичай візуалізоване фарбування інфікованих клітин з Фіолетовий Кристал, і вірусної нейтралізації титри розраховуються як взаємні останній розведення, при якому інфекція повністю заблокований. У нижній частині рисунка 6 представлені результати ВНА. Сироватка від мишей імунізованих з високою кількістю PR8 LAIV (104 ФФУ) мають найбільшу титр нейтралізуючих антитіл при сироваток від мишей імунізованих з Нижня дози або PR8 LAIV (102 ФФУ) мають низький титр нейтралізуючих антитіл, аналогічні результати отримані з Хай assay. З макет інфікованих мишей присутні не нейтралізують антитіл в сироватці крові.
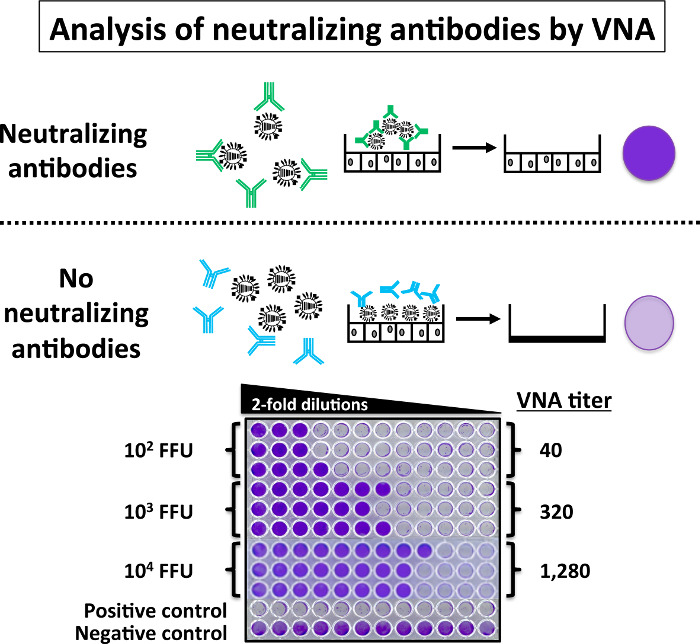
Малюнок 6: вірус Microneutralization Assay (ВНА): Альтернативою Хай assay, ВНА assay можна оцінити наявність PR8 WT нейтралізують антитіл. Якщо коротко, сірка від мишей, вакцинована зазначених доз PR8 LAIV були послідовно два рази розводили (початок розведення 1: 5) 96-ямковий пластини і змішати 1: 1 з 200 ФФУ PR8 WT для 1 h на RT. Після 1 h вірус сироватка суміші були використані для заразити 96-ямковий пластини MDCK клітин. Інфіковані клітини інкубували для 3-4 днів до повного цитопатического ефекту. Потім пластини 96-ямковий фарбували Фіолетовий Кристал 0,1%. ВНА титри визначаються шляхом виявлення високого розрідження зберегти вироджена осередку моношару. ВНА з PR8 WT були виконані в умовах BSL-2. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.
Оцінка ефективності захисту IAV вакцин в мишей
Коли розробляється новий LAIV, його ефективність, безпеку, імуногенність та захисту повинні бути перевірені в природних умовах, і миші модель є зазвичай першим тварин вирішили проаналізувати ці параметри. Малюнок 3 - це схема різних кроків, необхідних для характеристики нової LAIV мишей. Для оцінки безпеки LAIV (Малюнок 3А), мишей, інфікованих І.М., використовуючи аналогічний протокол для експериментальної процедури, описані в розділі патогенезу (розділ 4), і вага тіла і виживання моніторинг буде надавати інформацію, що стосується захворюваності і смертності LAIV (2B цифри 2A -), в тому числі MLD50. Крім того, після щеплення з різних доз, реплікація LAIV в нижньому (легкі) і верхню (слизової оболонки носа) дихальних шляхів повинно бути начісленних8,9,10, 11,29 (Малюнок 2D). Щоб перевірити імуногенність, сірка від мишей, вакцинована LAIV збираються перед викликом з PR8 WT (гомологічних виклик), використовуючи аналогічні протоколи для описаних в розділі імуногенності (розділ 5) (рис. 3B). Наявність загальної і нейтралізують антитіл в sera можуть бути виявлені ELISA і Хай і / або ВНА, відповідно.
Нарешті щоб перевірити ефективність захисту, щеплення LAIV мишей оскаржуються з PR8 WT і ефективність захисту характеризується моніторингу захворюваності, смертності та присутність виклик PR8 WT в легких, як описано в розділі 4 (Малюнок 3 c) 8,9,10,11. Якщо LAIV індукує захист від PR8 WT виклик, мишей не втратить вагу тіла, і вони виживуть смертоносних виклик з IAV WT. Крім того, IAV WT вірусний титри в легенях не будуть виявлені, або значно скоротиться в порівнянні з МОК (PBS) щеплення мишей8,9,10,11.
Засоби масової інформації культури тканини і рішенняСкладЗберіганняВикористанняКоментаріКультура тканини ЗМІ:
Дульбекко модифікована орла середнього (DMEM), 10% плода Bovine сироватки (ФБС), 1% пеніцилін-стрептоміцином-L-глютамин (ПСЖ) (DMEM 10% FBS 1 % PSG) 445 мл DMEM, 50 мл FBS і 5 мл 100 x 1% пеніцилін (100 одиниць / мл) -стрептоміціном (100 мкг / мл) - L - глютамін (2 мм) (ПСЖ) Зберігати при 4 ° C Цей носій використовується для обслуговування епітеліальних клітин нирок собак Мадін-Дарбі (MDCK) Післяопераційні інфекції ЗМІ: DMEM 0,3% альбуміну Bovine (BA), 1% ПСЖ (DMEM 0,3% Ба 1% PSG) 491 мл DMEM, 4.2 35 % Ба і 5 мл 100 x PSG Зберігати при 4 ° C Цей носій використовується для обслуговування MDCK клітин після зараження вірусом грипу A (IAV) 10 x-фосфатний буфер (10 x PBS) 80 г NaCl, 2 г хлористого калію, 11,5 г Na2HPO4.7H2O, 2г х2PO4. Додати ddH2O до 1 л регулювання рН 7.3 Зберігати при кімнатній температурі (RT) Стерилізувати в автоклаві ПБС Розбавити 10 x PBS 1:10 з ddH2O Магазин в РТ Стерилізувати в автоклаві Носіїв інфекції: 1 x PBS, 0,3% Ба, 1% пеніцилін -стрептоміціном (PS) (PBS / BA / PS) 487 мл ПБС стерильні, 4.2 мл 35% Ба і 5 мл 100 x 1% пеніцилін (100 одиниць / мл) -стрептоміціном (100 мкг / мл) (PS) Зберігати при 4 ° C Цей носій використовується для інфекції IAV Фіксація / permeabilization рішення: 4% формальдегіду, 0,5% Тритон X-100 розводять в одноразовому ПБС 400 мл нейтрального буферизуются формаліну 10%, 5 мл X-100 Тритон і 595 мл ПБС d> магазина в РТ Це рішення використовується для виправлення і руйнування MDCK клітини в експериментах вірусний титрування Готують розчин в витяжна шафа для запобігання впливу формальдегідів Блокування рішення: 2,5% бичачим сироватковим альбуміном (БСА) в одноразовому ПБС 2,5 г BSA в 97,5 мл ПБС Зберігати при 4 ° C Це рішення використовується як блокуючі рішення для аналізів імунофлюоресценції і ELISAs. Стерилізують фільтрацією з 0,2 мкм фільтром. Розчин антитіл розрідження (1% BSA в одноразовому ПБС) 1 г BSA в 99 мл ПБС Зберігати при 4 ° C Це рішення використовується для розведення первинних і вторинних антитіл в иммунофлуоресценции аналізів і ELISAs Стерилізують фільтрацією з 0,2 мкм фільтром 0,1% розчин фіолетовий Кристал 1 г фіолетовий Кристал в 400 мл метанолу. Додати 600 мл ddH2O Магазин в РТ Це рішення використовується для виправлення і пляма MDCK клітини в вірусної нейтралізації аналізів Tosylsulfonyl phenylalanyl хлорметил кетон (TPCK) -лікування трипсину Підготувати розчин тисячу x на 1 мг / мл в ddH2O Зберігати при температурі від-20 ° C TPCK -тріпсін додається в IAV інфекції Зробити 100 мкл аліквоти Буфер RIPA 10 мм трис-Cl (рН 8,0), 1 ЕДТА, 1% X-100 Тритон, дезоксихолат натрію 0,1%, 0.1% SDS, 140 мм NaCl Зберігати при 4 ° C Це рішення використовується для виготовлення клітин екстракти
Таблиця 1: Культура тканини ЗМІ і рішення.

