- Термодинамічні властивості [ правити | правити код ]
- Медичне застосування [ правити | правити код ]
- Фармакологічна дія [ правити | правити код ]
- показання [ правити | правити код ]
- Протипоказання [ правити | правити код ]
- Спосіб застосування та дози [ правити | правити код ]
- обережності [ правити | правити код ]
- Інші сфери застосування [ правити | правити код ]
open wikipedia design.
Перманганат калію ( лат. Kalii permanganas, поширена назва в побуті - марганцівка) - марганцевокислий калій , Калієва сіль марганцевої кислоти . Хімічна формула - KMnO4. Являє собою темно-фіолетові, майже чорні кристали, при розчиненні у воді утворюють яскраво забарвлений розчин кольору фуксії .
Зовнішній вигляд: темно фіолетові кристали з металевим блиском . Показник заломлення становить 1,59 (при 20 ° C).
Розчиняється в воді (див. Таблицю), рідкому аміаку , ацетоні (2: 100), метанолі , піридині .
Термодинамічні властивості [ правити | правити код ]
Є сильним окислювачем. Залежно від pH розчину окисляє різні речовини, відновлюючись до з'єднань марганцю різного ступеня окислення. У кислому середовищі - до з'єднань марганцю (II), в нейтральній - до з'єднань марганцю (IV), в сильно лужному - до з'єднань марганцю (VI). Приклади реакцій наведені нижче (на прикладі взаємодії з сульфитом калію ):
- в кислому середовищі:
2 KM n O 4 + 5 K 2 SO 3 + 3 H 2 SO 4 → 6 K 2 SO 4 + 2 M n SO 4 + 3 H 2 O {\ displaystyle {\ mathsf {2KMnO_ {4} + 5K_ {2} SO_ {3} + 3H_ {2} SO_ {4} \ rightarrow 6K_ {2} SO_ {4} + 2MnSO_ {4} + 3H_ {2} O}}}
- в нейтральному середовищі:
2 KM n O 4 + 3 K 2 SO 3 + H 2 O → 3 K 2 SO 4 + 2 M n O 2 + 2 KOH {\ displaystyle {\ mathsf {2KMnO_ {4} + 3K_ {2} SO_ {3} + H_ {2} O \ rightarrow 3K_ {2} SO_ {4} + 2MnO_ {2} + 2KOH}}}
- в лужному середовищі:
2 KM n O 4 + K 2 SO 3 + 2 KOH → K 2 SO 4 + 2 K 2 M n O 4 + H 2 O {\ displaystyle {\ mathsf {2KMnO_ {4} + K_ {2} SO_ {3} + 2KOH \ rightarrow K_ {2} SO_ {4} + 2K_ {2} MnO_ {4} + H_ {2} O}}}
Однак треба зазначити, що остання реакція (в лужному середовищі) йде за вказаною схемою тільки при нестачі відновника і високої концентрації лугу, яка забезпечує уповільнення гідролізу манганата калію.
При зіткненні з концентрованою сірчаною кислотою перманганат калію вибухає, однак при акуратному з'єднанні з холодною кислотою реагує з утворенням нестійкого оксиду марганцю (VII) :
2 KM n O 4 + H 2 SO 4 → K 2 SO 4 + M n 2 O 7 + H 2 O {\ displaystyle {\ mathsf {2KMnO_ {4} + H_ {2} SO_ {4} \ rightarrow K_ {2 } SO_ {4} + Mn_ {2} O_ {7} + H_ {2} O}}}
при цьому в якості проміжного продукту може утворюватися цікаве з'єднання - оксосульфат марганцю MnO3HSO4. За реакцією з фторидом йоду (V) можна отримати аналогічний оксофторід :
KM n O 4 + IF 5 → KF + IOF 3 + M n O 3 F {\ displaystyle {\ mathsf {KMnO_ {4} + IF_ {5} \ rightarrow KF + IOF_ {3} + MnO_ {3} F}} }
При нагріванні розкладається з виділенням кисню (Цим способом користуються в лабораторії для отримання чистого кисню). Схему реакції спрощено можна представити рівнянням:
2 KM n O 4 → ot K 2 M n O 4 + M n O 2 + O 2 {\ displaystyle {\ mathsf {2KMnO_ {4} {\ xrightarrow [{}] {^ {o} t}} K_ {2 } MnO_ {4} + MnO_ {2} + O_ {2}}}}
Насправді реакція йде набагато складніше, наприклад, при не дуже сильному нагріванні її можна приблизно описати рівнянням:
5 KM n O 4 → ot K 2 M n O 4 + K 3 M n O 4 + 3 M n O 2 + 3 O 2 {\ displaystyle {\ mathsf {5KMnO_ {4} {\ xrightarrow [{}] {^ {o} t}} K_ {2} MnO_ {4} + K_ {3} MnO_ {4} + 3MnO_ {2} + 3O_ {2}}}}
Реагує з солями двовалентного марганцю, наприклад:
2 KM n O 4 + 3 M n SO 4 + 2 H 2 O → 5 M n O 2 + K 2 SO 4 + 2 H 2 SO 4 {\ displaystyle {\ mathsf {2KMnO_ {4} + 3MnSO_ {4} + 2H_ {2} O \ rightarrow 5MnO_ {2} + K_ {2} SO_ {4} + 2H_ {2} SO_ {4}}}}
Ця реакція в принципі протилежна дисмутації ( диспропорционирование ) K2MnO4 на MnO2 і KMnO4.
Окисляє органічні речовини. Зокрема, розбавлені розчини перманганату калію в лужному і нейтральному середовищі окислюють алкени до діолів ( реакція Вагнера ):
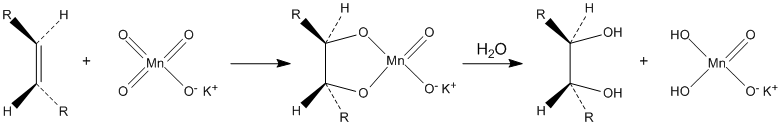
Водні розчини перманганату калію термодинамічно нестабільні, але кінетично досить стійкі. Їх збереження різко підвищується при зберіганні в темряві.
При суміші з пероксидом водню протікає наступна реакція:
2 KM n O 4 + 3 H 2 O 2 → 2 M n O 2 + 3 O 2 + 2 H 2 O + 2 KOH {\ displaystyle {\ mathsf {2KMnO_ {4} + 3H_ {2} O_ {2} \ rightarrow 2MnO_ {2} + 3O_ {2} + 2H_ {2} O + 2KOH}}}
Застосування цієї солі найчастіше засноване на високій окислюється здатності перманганат-іона, що забезпечує антисептичну дія.
Медичне застосування [ правити | правити код ]
Розбавлені розчини (близько 0,1%) перманганату калію знайшли найширше застосування в медицині як антисептичний засіб, для полоскання горла, промивання ран, обробки опіків . Як блювотний засіб для прийому всередину при отруєннях морфіном, аконітін і деякими іншими алкалоїдами використовують розведений (0,02-0,1%) розчин перманганату калію [1] .
Фармакологічна дія [ правити | правити код ]
антисептичний засіб . При зіткненні з органічними речовинами виділяє атомарний кисень . Утворений при відновленні препарату оксид утворює з білками комплексні сполуки - альбумінати (За рахунок цього калію перманганат в малих концентраціях має в'яжучу, а в концентрованих розчинах - подразнюючу, припікаючу і дубильними дію). Володіє також дезодорує. Ефективний при лікуванні опіків і виразок. Здатність калію перманганату знешкоджувати деякі отрути лежить в основі використання його розчинів для промивання шлунка при отруєннях невідомою отрутою і харчових токсикоинфекциях. При попаданні всередину всмоктується, надаючи дію (призводить до розвитку метгемоглобінемії ).
показання [ правити | правити код ]
Змазування виразкових і опікових поверхонь - інфіковані рани, виразки та опіки шкіри. Полоскання порожнини рота і ротоглотки - при інфекційно-запальних захворюваннях слизової оболонки порожнини рота і ротоглотки (в тому числі при ангінах). Для промивання та спринцювання при гінекологічних та урологічних захворюваннях - кольпіти і уретрити. Для промивань - шлунка при отруєннях, викликаних прийомом всередину алкалоїдів ( морфін , аконітін , нікотин ), синильною кислотою , фосфором , хініном ; шкіри - при попаданні на неї аніліну ; очей - при ураженні їх отруйними комахами.
Протипоказання [ правити | правити код ]
Гіперчутливість.
При передозуванні: різкий біль в порожнині рота, по ходу стравоходу, в животі, блювота, діарея; слизова оболонка порожнини рота і глотки - набрякла, темно-коричневого, фіолетового кольору, можливий набряк гортані, розвиток механічної асфіксії, опікового шоку, рухового збудження, судом, явищ паркінсонізму, геморагічного коліту, нефропатії, гепатопатии. При зниженій кислотності шлункового соку можливий розвиток метгемоглобінемії з вираженим ціанозом і задишкою. Смертельна доза для дітей - близько 3 г, для дорослих - 0,3-0,5 г / кг.
лікування: метиленовийсиній (50 мл 1% розчину), аскорбінова кислота (Внутрішньовенно - 30 мл 5% розчину), ціанокобаламін - до 1 мг, піридоксин (Внутрішньом'язово - 3 мл 5% розчину).
Спосіб застосування та дози [ правити | правити код ]
Зовнішньо, у водних розчинах для промивання ран (0,1-0,5%), для полоскання рота і горла (0,01-0,1%), для змазування виразкових і опікових поверхонь (2-5%), для спринцювання (0,02-0,1%) в гінекологічної та урологічної практиці, а також промивання шлунка при отруєннях.
обережності [ правити | правити код ]
Активно взаємодіє при нагріванні і навіть при кімнатній температурі з більшістю восстановителей, наприклад, органічними речовинами ( сахарозою , танинами , гліцерином і багатьма іншими), легкоокислюваних речовинами, тому при змішуванні відбувається саморазогреванія, що іноді викликає самозаймання суміші (з концентрованим розчином гліцерину , Або безводних - завжди) і може призвести до вибуху.
Дуже небезпечно розтирання сухого перманганату калію з органічними речовинами і порошками активних металів і неметалів ( кальцієм , алюмінієм , магнієм , фосфором , сірої та ін.) - досить імовірний вибух.
Інші сфери застосування [ правити | правити код ]
- 1-2% розчин використовується садівниками для протруювання насіння перед посадкою [2]
- Застосовується для визначення перманганатной окисляемости при оцінці якості води згідно з ГОСТ 2761-84 по методу Кубель [1] .
- Лужний розчин перманганату калію добре відмиває лабораторний посуд від жирів і інших органічних речовин.
- Розчини (концентрації приблизно 3 г / л) широко застосовуються при тонуванні фотографій.
- У піротехніці застосовують в якості сильного окислювача.
- Застосовують як каталізатор розкладання перекису водню в космічних рідинно-ракетних двигунах.
- Водний розчин перманганату калію використовується для травлення дерева, як морилки.
- Водний розчин застосовується також для виведення татуювань. Результат досягається за допомогою хімічного опіку, при якому відмирають тканини, в яких міститься барвник. Даний метод трохи відрізняється від простого зрізання шкіри, зазвичай він менш ефективний і більш неприємний, так як опіки заживають набагато довше. Татуювання не видаляється повністю, на її місці залишаються шрами.
- Перманганат калію або біхромат натрію використовуються в якості окислювача при отриманні мета- і парафталевих кислот з мета- і Параксилол відповідно (див. Терефталева кислота ).
Хімічне або електрохімічне окислювання сполук марганцю, диспропорционирование манганата калію. наприклад:
2 M n O 2 + 3 C l 2 + 8 KOH → 2 KM n O 4 + 6 KC l + 4 H 2 O {\ displaystyle {\ mathsf {2MnO_ {2} + 3Cl_ {2} + 8KOH \ rightarrow 2KMnO_ { 4} + 6KCl + 4H_ {2} O}}} 2 K 2 M n O 4 + C l 2 → 2 KM n O 4 + 2 KC l {\ displaystyle {\ mathsf {2K_ {2} MnO_ {4} + Cl_ {2} \ rightarrow 2KMnO_ {4} + 2KCl} }}
3 K 2 M n O 4 + 2 H 2 O → 2 KM n O 4 + M n O 2 + 4 KOH {\ displaystyle {\ mathsf {3K_ {2} MnO_ {4} + 2H_ {2} O \ rightarrow 2KMnO_ {4} + MnO_ {2} + 4KOH}}}
2 K 2 M n O 4 + 2 H 2 O → 2 KM n O 4 + H 2 ↑ + 2 KOH {\ displaystyle {\ mathsf {2K_ {2} MnO_ {4} + 2H_ {2} O \ rightarrow 2KMnO_ { 4} + H_ {2} \ uparrow + 2KOH}}}
Остання реакція відбувається при електролізі концентрованого розчину манганата калію і ендотермічна, вона є основним промисловим способом отримання перманганату калію.
Входить в IV список прекурсорів ПККН в Росії [3] (Допускається виключення деяких заходів контролю).
14 червня 2013 на Україна був визнаний прекурсором і внесений до списку наркотичних речовин [4] .
- Вульфсон Н. С. Препаративна органічна хімія, с. 656, 657.
- Казанський Б. А. (ред.) Синтези органічних препаратів (збірник 3), с. 145.
- Ремі Г. Курс неорганічної хімії (том 1), с. 817.

