Зміна фосфорно-кальцієвого обміну є один з найбільш несприятливих синдромів розвивається хронічної ниркової недостатності (ХНН). KDIGO® (2009) класифікує мінеральні і кісткові порушення при хронічній хворобі нирок (ХХН-МКН) наступним чином [1, 2].
Системне порушення кістково-мінерального метаболізму, обумовлене ХХН і маніфестує одним з таких ознак або їх комбінацією:
- відхилення в метаболізмі кальцію, фосфору, ПТГ (СМТ) або вітаміну D;
- порушення обміну кістки, мінералізації, обсягу, лінійного росту або її міцності;
- судинна або тканинна кальцифікація.
KDIGO® (2009) [2] рекомендує моніторинг сироваткових рівнів кальцію, фосфату, ПТГ та активності лужної фосфатази (ЛФ), починаючи з ХХН 3-й стадії (1С), а у дітей пропонується починати таке моніторування з ХХН 2-й стадії ( 2D).
Доцільними можуть бути наступні інтервали моніторування (табл. 1):
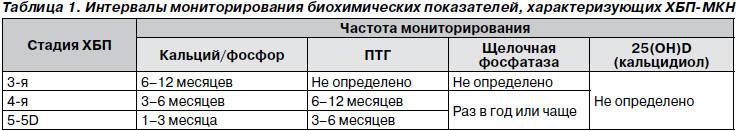
- при ХХН 3-й стадії: для кальцію і фосфату сироватки кожні 6-12 місяців; і для ПТГ - грунтуючись на його початковому рівні і темпах прогресування ХХН;
- при ХХН 4-й стадії: для кальцію і фосфату сироватки - кожні 3-6 місяців; і для ПТГ - кожні 6-12 місяців;
- при ХХН 5-й стадії, включаючи 5D: для кальцію і фосфату сироватки - кожні 1-3 місяці, і для ПТГ - кожні 3-6 місяців;
- при ХХН 4-5D стадій: рівень активності лужної фосфатази - кожні 12 місяців або частіше при наявності підвищеного рівня ПТГ.
У пацієнтів з ХХН, які отримують лікування з приводу ХХН-МКН, або у тих, у кого виявлені біохімічні порушення, доцільно збільшити частоту вимірювань для моніторування їх трендів, ефективності терапії і побічних ефектів (рівень доказовості не класифікується). На додаток у пацієнтів з ХХН 3-5D стадій можливе вимірювання рівня 25 (ОН) D (кальцидіолу) з частотою повторних вимірів, яка визначається початковим рівнем і проведеною терапією (2С). При корекції дефіциту і недостатності вітаміну D KDIGO® (2009) [2] пропонує використовувати лікувальні стратегії, рекомендовані для загальної популяції (2С).
Початком розвитку кістково-мінеральних порушень є зниження здатності нирок до екскреції фосфатів на тлі практично незмінного їх всмоктування в кишечнику [3]. Зниження СКФ (<60 мл / хв) і секреторної функції канальців призводить до сукупного зменшення виведення фосфатів. Гіперфосфатемія є потужним фактором збільшення продукції ПТГ, який компенсаторно підсилює екскрецію фосфатів, одночасно стимулюючи вихід кальцію з кісток і збільшення синтезу вітаміну D. Однак гиперкальциемия не настає, чому сприяє контроль з боку Тиреокальцитонін, який також посилює і секрецію фосфору. Таким чином, при ХХН 2-3-й стадії рівні фосфору і кальцію залишаються нормальними, а рівень паратгормону поступово підвищується (рис. 1).
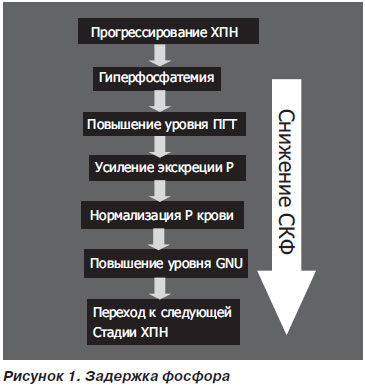
У міру прогресування ниркової недостатності розвивається резистентність канальцевого апарату нирок до дії ПТГ. Для посилення екскреції фосфору організмом починає більш активно використовуватися вітамін D, що збільшує виведення фосфатів, але, крім цього, стимулюючий всмоктування кальцію (і в меншій мірі фосфору) в кишечнику і реабсорбцію кальцію в нирках. Нагадаємо, що вітамін D2 (ергокальциферол) надходить з їжею, вітамін D3 (холекальциферол) утворюється в шкірі під впливом ультрафіолетових променів. Вітаміни D2 і D3 піддаються першому гидроксилированию в печінці, де в подальшому і зберігаються його основні запаси. При цьому D3 перетворюється в 25-гідроксихолекальциферол (25-OH-D3) - кальцідіол, а D2 - в 25-гідроксіергокальціферол (25-OH-D2). Це перетворення каталізує фермент 25-гідроксилази. 25-гідроксікальціфероли - основна транспортна форма вітаміну D в організмі. У плазмі крові вони (як і інші форми вітаміну) переносяться специфічним транспортним білком - транскальціферіном. Друге гидроксилирование відбувається в нирках, де з 25-OH-D3 за допомогою 1-a-гідроксилази утворюється біологічно активний вітамін D3 (1,25-дігідроксіхолекальціферол, або кальцитріол), а за допомогою 24-гідроксилази - 24,25 (OH) 2 -D3. Аналогічно з 25-OH-D2 утворюються 1,25 (OH) 2-D2 і 24,25 (OH) 2-D2. Найбільш активна форма D3, відповідальна за його функції, - 1,25 (OH) 2-D3. Її біологічне дію в 10 разів перевищує активність інших форм, тому, говорячи про дефіцит вітаміну D при ХХН, перш за все мають на увазі недостатній синтез активного метаболіту вітаміну D3.
Найважливіші регулятори, що активують синтез 1,25 (OH) 2-D3: паратиреоїдного гормон, естроген, пролактин, соматотропін та інсулін. Збільшення концентрації фосфору посилює секрецію паратгормону, який активує в нирках 1-a-гідроксилази, в результаті чого прискорюється синтез 1,25 (OH) 2-D3. Надмірне надходження Са2 + і фосфору з їжею пригнічує синтез 1,25 (OH) 2-D3, так як при цьому його попередник 25- (OH) -D3 перетворюється в нирках в 24,25 (OH) 2-D3, який стимулює всмоктування кальцію і фосфору в кишечнику так само ефективно, як 1,25 (OH) 2-D3, і одночасно стимулює остеогенез і мінералізацію кісткової тканини [3].
У пацієнтів з ХХН 3-4-й стадії в різні терміни розвивається спочатку функціональний, а потім абсолютний дефіцит вітаміну D3 (кальцидіолу і потім кальцитріолу) за рахунок зменшення маси функціонуючої паренхіми, яка продукує 1-a-гідроксилази. Основне патоморфологічне наслідок розвивається недостатності вітаміну D - порушення мінералізації кісткової тканини. Біологічна активність вітаміну D вимірюється в міжнародних (інтернаціональних) одиницях (ME); 1 ME відповідає активності 0,025 мкг ерго або холекальциферолу. Зміст D2 і D3 в продуктах харчування невелика, наприклад в печінці бика і вершковому маслі відповідно 0,4 і 0,4-3,2 МО / г. Виняток становлять жир печінки тріски і тунця, в яких цих вітамінів міститься відповідно 50-350 і 40 000-60 000 МЕ / мл. Потреба людини у вітаміні D, складова 400 ME (10 мкг) на добу, при достатній і регулярної інсоляції забезпечується фотохимическим синтезом D3 в шкірі або за рахунок надходження з їжею. Однак за рахунок харчового раціону і впливу ультрафіолетових променів компенсувати недолік вітаміну у пацієнтів з ХХН неможливо. Тому як лікувальну опцію для пацієнтів з ХХН 3-4-й стадії KDOQI рекомендували цільове сироваткове зміст гідроксихолекальциферолу (25 (OH) D), тобто кальцидіолу (неактивного вітаміну D3) в дозі> 75 ммоль / л, як і для всього населення. Його заповнення можливо за рахунок будь-яких форм вітаміну D.
Таким чином, при ХХН 3-4-й стадії рівень фосфору в крові залишається ще нормальним, маючи тенденцію до підвищення, рівень кальцію залишається нормальним, маючи тенденцію до зниження, рівень ПТГ поступово підвищується, рівні вітаміну D3 і його активного метаболіту поступово знижуються. Слід зазначити, що за рахунок взаємодії з різними доменами в тканинах організму вітамін D3 реалізує і інші ефекти, не пов'язані безпосередньо з синтезом ПТГ: зниження активності РААС і протеїнурії, зменшення гіпертрофії лівого шлуночка, захист від атеросклерозу і протипухлинний ефект.
При досягненні ХХН 5-й стадії функціональний дефіцит вітаміну D переходить в органічний, так як через різке зниження вироблення 1-a-гідроксилази практично припиняється синтез активного метаболіту вітаміну - кальцитріолу. У зв'язку з цим для лікування ХХН 5-й стадії KDOQI не рекомендують призначати нативний вітамін D, віддаючи пріоритет активних форм вітаміну D3 або D2. Формується дефіцит вітаміну D обумовлює розвиток гіпокальціємії. Таким чином, при ХХН мають місце наростаюча гиперфосфатемия, гіпокальціємія, дефіцит вітаміну D (особливо його активного метаболіту) і все наростаюча вироблення ПТГ (рис. 2).
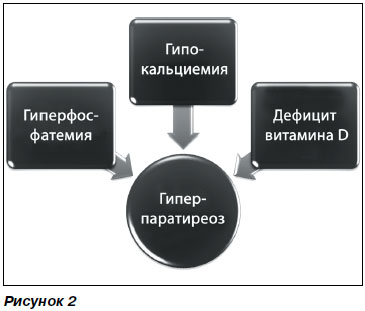
Гіпокальціємія при дефіциті вітаміну D сприяє не тільки гіперпродукції ПТГ (вторинний гіперпаратиреоз, або гиперпаратиреоидизм), але і подальшої гіперплазії паращитовидних залоз і розвитку їх аденоми. Ця гіперплазована тканину вже малочутлива до регулюючого впливу кальцію і вітаміну D. Вважається, що кількість кальцієвих рецепторів в вузлах паращитовидной залози зменшується майже на 60%.
Кальцій і вітамін D3 практично незалежно один від одного регулюють вироблення ПТГ через різні рецептори: кальційраспознающій рецептор (КР) і трансмембранний вітамін-D3-рецептор (ВР). КР є поверхневим мембранним рецептором, що знаходяться в неактивному стані при низькому вмісті позаклітинного кальцію, що визначає постійний синтез ПТГ і є сигналом до збільшення кількості КР. При підвищенні вмісту кальцію активується КР, що швидко викликає зниження кількості ПТГ за рахунок пригнічення його синтезу і секреції. Одночасно зменшується експресія КР. Однак, якщо низький вміст кальцію зберігається в позаклітинній рідині більше кількох хвилин, активізуються механізми транскрипції і починається проліферація паратиреоїдних клітин. Вітамін діє значно повільніше, так як для реалізації ефекту йому необхідно проникнути всередину клітини паращитовидної залози, зв'язатися з ядерним рецептором і тільки потім викликати ефект придушення генної транскрипції, що приводить до зниження синтезу ПТГ. Таким чином, етіологічними факторами вторинного гіперпаратиреозу є послідовно розвиваються гиперфосфатемия, потім дефіцит активного вітаміну D3 і гіпокальціємія [3].
Фосфор впливає на процеси прямої і непрямої кальцифікації. Підвищений внутрішньоклітинний кальцій утворює ядро апатитового депозиту в з'єднанні з фосфором. Непряма кальцифікація відбувається за допомогою розвитку гіперпаратиреоїдизму: тривале підвищення рівня фосфору безпосередньо стимулює синтез ПТГ і веде до гіперплазії паратиреоїдних залоз, а ПТГ підвищує базальний рівень внутрішньоклітинного кальцію.
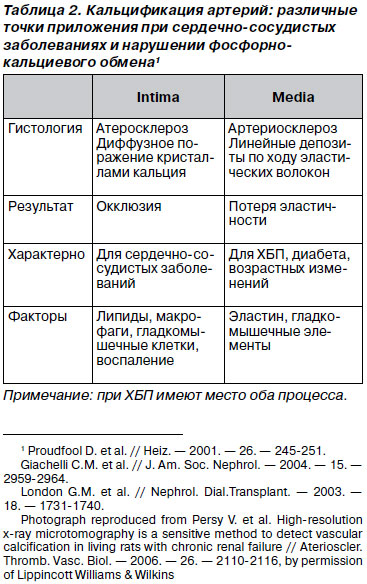
Порушення фосфорно-кальцієвого обміну формують два основних провідних синдрому: резорбцію кісткової тканини і ектопічну кальцифікацію. Найбільш несприятливою є кальцифікація серцево-судинної системи, клінічна значимість якої полягає у фатальному підвищення ризиків кардіоваскулярної смерті. KDIGO® (2009) [2] пропонує, щоб у пацієнтів із ХХН 3-5D стадій була можливість використання латеральної абдомінальної рентгенографії для виявлення наявності або відсутності судинної кальцифікації, а ехокардіографії - для визначення наявності або відсутності клапанної кальцифікації як розумних альтернатив візуалізації, заснованої на комп'ютерної томографії (2C). При цьому пропонується вважати пацієнтів з ХХН 3-5D стадій з наявністю судинної / клапанної кальцифікації мають найбільш високий серцево-судинний ризик (2А).
Кальцифікація фосфатами кальцію починається з інтими судин і в подальшому захоплює м'язовий шар, формуючи жорсткість судин. Кальцифікація, яка відбувається в результаті порушень фосфорно-кальцієвого обміну, дещо відрізняється від ураження судин при кардіоваскулярних захворюваннях. Однак при ХХН мають місце обидва типи порушень (табл. 2).
У серцевому м'язі також утворюються осередки ектопічних кальцификатов, що знижує нагнетательную здатність міокарда. Процес формування ектопічних кальцификатов стимулюється появою остеобластоподобних клітин, депозіціей кристалів фосфату кальцію, збільшенням FGF 23, фетуіна А, матричних протеїнів Gla і рядом інших сигнальних молекул. Саме зростання FGF 23 в даний час приділяється велика увага в оцінці прогресування фосфорно-кальцієвих порушень при ХХН. Клінічним наслідком ектопічної кальцифікації серцево-судинної системи є розвиток аритмій (раптова смерть), серцевої недостатності та підвищення смертності від усіх кардіоваскулярних подій. При цьому слід пам'ятати, що нирково-замісна терапія не дозволяє повністю виключити негативний вплив обмеженою функції нирок на серцево-судинну смертність (рис. 3). Серед інших проявів ектопічної кальцифікації найбільш часто документують ураження легень, шкіри і навколосуглобових апарату.

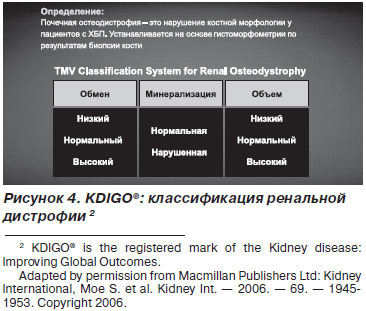
Другий життєво важливий патологічний синдром - порушення цілісності кісткової тканини з формуванням ренальної остеодистрофії. KDIGO® передбачає 3 ключових процесу в оцінці ренальної остеодистрофії: Turnover, Mineralization, Volume (TMV) (рис. 4, 5).
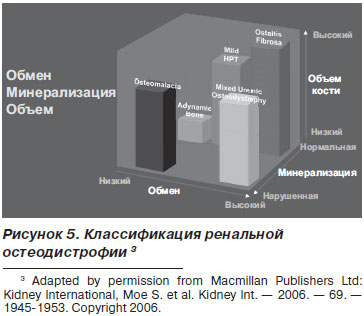
Залежно від метаболізму кісткової тканини розрізняють фіброзний остеит, остеомаляцію, адінаміческіе хвороба нирок і змішані порушення (рис. 6).
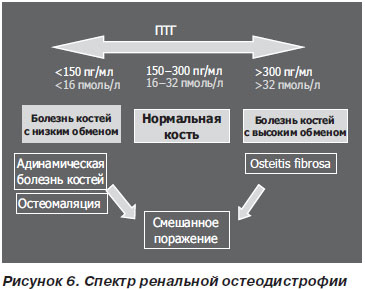
У практиці спрощено виділяють два види порушень: з високим (фіброзний остеит) і низьким обміном (адінаміческіе порушення, остеомаляція). В основі цих порушень лежить різна регулююча концентрація ПТГ, активність остеокластів / остеобластів і кісткової лужної фосфатази.
Підвищений рівень ПТГ стимулює остеобласти, забезпечуючи зростання активності обміну в кістковій тканині і формуючи фіброзно-кістозний остеит. Високий рівень обміну в кістках призводить до утворення невпорядкованого остеоіда, фіброзу і утворення кіст, в результаті чого стоншується кортикальная кістка, знижується міцність кістки і підвищується ризик переломів (KDOQI, 2003). Цей вид кістково-мінеральних порушень зараз зустрічається рідше зважаючи на активну супровідної терапії вітаміном D.
Адінаміческіе порушення і остеомаляція характеризуються зниженням кісткового обміну або ремоделювання зі зменшеним числом остеокластів і остеобластів, а також придушенням остеобластной активності. При остеомаляції спостерігається накопичення немінералізованние кісткового матриксу, тобто збільшення обсягу остеоіда, що може викликатися дефіцитом вітаміну D або накопиченням алюмінію. Адінаміческая остеодистрофія характеризується зниженням обсягу кістки і її мінералізації та може викликатися накопиченням алюмінію або надмірною придушенням секреції ПТГ за допомогою кальцитріолу.
Адінаміческіе порушення кістки (хвороба адинамической кістки, адінаміческая остеодистрофія) характеризуються порушенням утворення матриксу кістки, мінералізації кістки і зниженням резорбції кістки на тлі низького / нормального рівня ПТГ і низького рівня кістково-специфічної лужної фосфатази. Нерідко адінаміческіе порушення виникають при передозуванні кальцієвих фосфатних біндеров і вітаміну D. Пацієнти, які страждають адінаміческімі порушеннями кістки, виглядають старшими за свій вік, частіше хворіють супутніми захворюваннями, мають діабет, більш виражені атеросклеротичні зміни і МІА-синдром (мальнутріція, запалення, атеросклероз).
KDIGO® (2009) [2] в діагностиці кістково-мінеральних порушень при ХХН 3-5D стадій вважає за доцільне виконувати біопсію кістки при незрозумілих переломах, стійких болях в кістках, незрозумілою гіперкальціємії, незрозумілою гипофосфатемии, можливої алюмінієвої інтоксикації, а також перед початком лікування бісфосфонатами у пацієнтів з ХХН-МКН (рівень доказовості не класифікується). У пацієнтів з ХХН 3-5D стадій з ознаками ХХН-МКН пропонується не проводити рутинне тестування мінеральної щільності кістки (МПК), так як у них на відміну від загальної популяції МПК не передвіщає ризик переломів і ниркової остеодистрофії (2B). У пацієнтів з ХХН 3-5D стадій пропонується використання вимірювання ПТГ сироватки або кістково-специфічної лужної фосфатази для оцінки захворювання кістки, оскільки помітно підвищені або знижені їх значення пророкують лежить в основі кістковий обмін (2B). У дітей у віці до 2 років з ХХН 2-5D стадій слід вимірювати довжину тіла принаймні щоквартально, у той час як у дітей старшого віку з ХХН 2-5D стадій лінійне зростання слід оцінювати принаймні щорічно (1В).
Для лікування кістково-мінеральних порушень ХХН і вторинного гіперпаратиреозу використовують дієту, призначають фосфатбіндери, вітамін D, а у діалізних пацієнтів - нізкокальціевие розчини (1,25 ммоль / л) при гіперкальціємії, висококальційсодержащіе (> 1,4 ммоль / л) - при гіпокальціємії , а також кальціміметікі (тільки при нирково-замісної терапії) при неефективності терапії аналогами вітаміну D і вираженому гиперпаратиреозе.
KDIGO® (2009) [2] у пацієнтів з ХХН 3-5-й стадій пропонує підтримувати рівень фосфору сироватки в нормі (2С), а у пацієнтів з ХХН 5D стадії - знижувати підвищений рівень фосфату в напрямку нормальних значень (2С). У пацієнтів з ХХН 3-5D стадій також пропонується підтримувати рівень кальцію сироватки в нормі (2D). У пацієнтів з ХХН 5D стадії пропонується використовувати діалізат з концентрацією кальцію 1,25-1,50 ммоль / л (2,5 і 3,0 мЕкв / л) (2D).
Початковим і необхідним етапом лікування є дієта. Пацієнтам з ХХН 3-5D стадій при лікуванні гиперфосфатемии KDIGO® (2009) [2] пропонує обмеження споживання фосфату з їжею окремо або в поєднанні з іншими видами терапії (2D). При цьому у пацієнтів з ХХН 5D стадії при лікуванні персистуючої гиперфосфатемии пропонується збільшення виведення фосфату на діалізі (2С).
Зазвічай гіпофосфатемічному дієта містіть 800-1000 мг фосфатів на добу. З урахуванням ряду соціальних складнощів, особливо у осіб молодого віку, більш доступним методом є використання фосфатбіндеров - препаратів, молекули яких, всмоктуючись з кишечника, пов'язують фосфор і виводять його з організму у вигляді нерозчинних речовин (табл. 3). У пацієнтів з ХХН 3-5-й стадій (2D) і 5D стадії (2В) KDIGO® (2009) [2] пропонує використовувати фосфатсвязивающіе препарати, приймаючи до уваги стадію ХХН, наявність інших проявів ХХН-МКН, супутню терапію і профіль побічних ефектів (рівень доказовості не класифікується).
![У пацієнтів з ХХН 3-5-й стадій (2D) і 5D стадії (2В) KDIGO® (2009) [2] пропонує використовувати фосфатсвязивающіе препарати, приймаючи до уваги стадію ХХН, наявність інших проявів ХХН-МКН, супутню терапію і профіль побічних ефектів (рівень доказовості не класифікується)](/wp-content/uploads/2020/01/uk-fosforno-kalcievij-obmin-pri-hronicnij-hvorobi-nirok-9.jpg)
У пацієнтів з ХХН 3-5D стадій і гіперфосфатемією в разі персистуючої або періодичної гіперкальціємії KDIGO® (2009) [2] рекомендує скорочення дози кальцийсодержащих фосфатсвязивающіх препаратів і / або дози кальцитріолу або аналогів вітаміну D (1В). Пропонується також скорочення дози кальцийсодержащих фосфатсвязивающіх препаратів у пацієнтів з ХХН 3-5D стадій і гіперфосфатемією при наявності кальцифікації артерій (2С), і / або адинамической хвороби кісток (2С), і / або в разі постійно низького рівня ПТГ сироватки (2С). У пацієнтів з ХХН 3-5D стадій рекомендується уникати тривалого застосування алюминийсодержащих фосфатсвязивающіх препаратів і у пацієнтів з ХХН 5D стадії уникати забруднення діалізата алюмінієм для запобігання алюмінієвої інтоксикації (1С).
Алюминийсодержащие фосфатбіндери, незважаючи на їх гарну ефективність, в даний час практично не використовуються через високі ризики кумуляції алюмінію з наступним розвитком енцефалопатії і ураження кісток (1С). Кальцієві біндери при їх абсолютної дешевизні нерідко призводять до гіперкальціємії. У зв'язку з цим рекомендації KDIGO® (2009) [2] припускають при СКФ менше 60 мл / хв у пацієнтів з гіперфосфатемією в разі персистуючої або періодичної гіперкальціємії скорочення дози кальцийсодержащих фосфатсвязивающіх препаратів і / або дози кальцитріолу або аналогів вітаміну D (1В). Рекомендації також пропонують скорочення дози кальцийсодержащих фосфатсвязивающіх препаратів у пацієнтів з СКФ менше 60 мл / хв і гіперфосфатемією при наявності кальцифікації артерій (2С), і / або адинамической хвороби кісток (2С), і / або в разі постійно низького рівня ПТГ сироватки (2С) . У зв'язку з цим для корекції гиперфосфатемии частіше застосовується севеламер.
До теперішнього часу накопичено достатньо переконливих даних про високу ефективність севеламер в зниженні гиперфосфатемии. Разом з тим досягнення нормальних значень фосфатів покликане, перш за все, зменшити смертність пацієнтів. В одному з останніх рандомізованих багатоцентрових досліджень INDEPENDENT (Biagio Di Iorio et al., 2012) проведено пряме порівняння кальцію карбонату і севеламер у 212 пацієнтів з ХХН (СКФ 59-15 мл / хв) протягом 36 місяців. Було переконливо продемонстровано зниження смертності від усіх причин і комбінованої кінцевої точки «смертність» або «початок діалізу» у пацієнтів, регулярно отримували севеламер. Можливо, це пояснюється більш високою частотою коронарної кальцифікації у пацієнтів, які отримують кальцій фосфатні біндери (R. Shantouf et al., 2010).
В даний час севеламер випускається в карбонатної солі (Renvela), яка замінила гідрохлорид (Renagel), який посилював прояви ацидозу. Дозування севеламер залишилася колишньою, титруються від 1600 мг (1 капсула двічі на добу) до 3200 мг / добу. Фактично севеламер сьогодні визнається як перша опція вибору серед фосфатбіндеров в лікуванні ХХН-МКН.
У пацієнтів з ХХН 3-5-й стадій, які не перебувають на діалізі, оптимальний рівень ПТГ не відомий. KDIGO® (2009) [2] пропонує у пацієнтів з рівнем интактного ПТГ (ІПТГ) вище верхньої межі норми для даного методу в першу чергу оцінювати наявність гиперфосфатемии, гіпокальціємії і дефіциту вітаміну D (2С). Доцільно коригувати ці порушення усіма нижченаведеними методами або одним з них: зменшенням споживання фосфатів з їжею і призначенням фосфатсвязивающіх препаратів, сапплементаціей кальцію і / або нативним вітаміном D (рівень доказовості не класифікується).
У пацієнтів з ХХН 3-5-й стадій, які не перебувають на діалізі, у яких сироватковий ПТГ прогресивно наростає і залишається постійно вище верхньої межі норми для даного методу визначення, незважаючи на корекцію модифікуються факторів, KDIGO® (2009) [2] пропонує терапію кальцитріолом або аналогами вітаміну D (2С). У пацієнтів з ХХН 5D стадії пропонується підтримувати рівень ІПТГ приблизно в інтервалі 2-9-кратного перевищення верхньої межі норми для даного методу (2С), а наявність виражених відхилень рівня ПТГ в будь-яку сторону всередині зазначеного діапазону має спонукати до початку або зміни терапії щоб уникнути прогресування до значень, що виходять за межі вказаного інтервалу (2С).
У пацієнтів з ХХН 5D стадії і збільшеним або підвищується рівнем ПТГ KDIGO® (2009) [2] пропонує використовувати кальцитріол, або аналоги вітаміну D, або кальціміметікі, або комбінацію кальціміметіков з кальцитріолом або аналогами вітаміну D для зниження рівня ПТГ (2В). Доцільно, щоб початковий вибір препарату для лікування підвищеного рівня ПТГ базувався на рівнях кальцію і фосфату сироватки, а також на інших проявах ХХН-МКН (рівень доказовості не класифікується). Доцільно підбирати дозу кальцію або що не містять кальцій фосфатсвязивающіх препаратів таким чином, щоб лікування, спрямоване на контроль рівня ПТГ, не порушувало рівень кальцію і фосфату (рівень доказовості не класифікується). KDIGO® (2009) [2] рекомендує знижувати дозу або скасовувати кальцитриол або інший стерол вітаміну D у пацієнтів з гіперкальціємією (1В) і з гіперфосфатемією (2D). Також пропонується зменшувати дозу кальціміметіков або скасовувати їх у пацієнтів з гипокальциемией в залежності від її тяжкості, супутньої терапії і клінічних симптомів (2D). KDIGO® (2009) [2] пропонує зменшувати або скасовувати прийом кальцитріолу, аналогів вітаміну D і / або кальціміметіков, якщо рівень інтактного ПТГ знижується в два рази нижче верхньої межі норми для даного методу його визначення (2С). Пацієнтам з ХХН 3-5D стадій з важким гиперпаратиреозом, які не відповіли на медикаментозну / фармакологічну терапію, KDIGO® (2009) [2] пропонує виконувати паратиреоїдектомії (2В).
Слід підкреслити, що терапевтичне вікно 1,25 (OH) 2D3 досить вузьке і лікування вітаміном D пов'язано з підвищеним ризиком кардіоваскулярних кальцифікація, які частково можуть бути пов'язані з гіперкальціємією, гіперфосфатемією, збільшенням активності кісткової лужної фосфатази, остеопонтіна і зменшенням секреції гладком'язовими судинними клітинами ПТГ -зв'язано пептиду. Дози 1,25 (OH) 2D3, оптимальні для заповнення дефіциту гормону, але не для розвитку токсичних ефектів, все ще не встановлені. Щомісячний контроль ПТГ при використанні кальцитриола дозволяє підібрати правильну дозу. Однак навіть при передозуванні токсичний ефект лікувальних доз 1,25 (OH) 2D3 потенційно звернемо. Крім того, токсичний ефект лікувальних доз 1,25 (OH) 2D3 може бути зменшений при призначенні кальціміметіков.
Слід нагадати, що вітамін D3, реалізуючи свій ефект, взаємодіє з цілим каскадом сигнальних молекул, а саме: сироватковим вітамін-D3-зв'язуючим протеїном, мембранним рецептором, 25-гидроксивитамина-D3-24-гідроксилази (CYP24) і, нарешті, ядерним рецептором . Сучасні препарати можуть викликати активацію рецептора вітаміну за допомогою не тільки активного метаболіту вітаміну D3, а й активного метаболіту вітаміну D2 (1,25-дигідроксивітамін D2), наприклад парікальцітола. При прямому порівнянні з кальцитріолом гіперкальціємія і гіперфосфатемія залишаються однаковими, але терміни збереження гіперкальціємії дещо коротший при призначенні парікальцітола, що пов'язують з меншою активацією КР в кишечнику. Визнано за доцільне використання активних форм вітаміну D у пацієнтів, які отримують діаліз, і, можливо, після трансплантації нирки.
Разом з тим відомо, що існує позанирковий синтез активного метаболіту вітаміну D в макрофагах, ендотелії, передміхуровій залозі, молочній залозі і головному мозку. При зниженні синтезу кальцитріолу в нирках зазначені тканини підсилюють свій локальний синтез, хоча він мало порівняємо з нирковим. Локальна вироблення 1,25 (OH) 2D3 модулює ряд клітинних функцій для продовження життя пацієнтів з ХХН. Тому доцільність призначення обох форм вітаміну, можливо, обумовлена не тільки замісної функцією кальцитріолу, а й забезпеченням субстрату для незалежних позаниркових ефектів, службовців профілактикою атеросклерозу, гіпертензії, імунодефіциту і розвитку раку.
Кальціміметікі збільшують чутливість кальційраспознающего рецептора і знижують рівень кальцію і ПТГ. Розрізняють кальціміметікі І (неорганічні речовини, наприклад Mg2 +, Gd3 +, аміноглікозиди, спермін) і ІІ типів. Цинакальцета - кальціміметік ІІ типу, перший широко застосовуваний препарат у діалізних пацієнтів з неефективним результатом терапії вітаміном D. Добова доза становить 60-180 мг в один прийом. При ХХН 3-4-й стадії цинакальцета може викликати гіпокальціємію і Гіперфосфатемія. Однак триває накопичення клінічного досвіду застосування цинакальцета у пацієнтів з ХХН 3-4-й стадії і у посттрансплантаційних хворих. Кальціміметікі рекомендуються для тривалого постійного прийому, при цьому доза вітаміну D може бути зменшена.
Підсумовуючи вищевикладене, вплив застосовуваних в даний час препаратів можна представити таким чином (табл. 4).

Однак у деяких хворих перераховані заходи не призводять до нормалізації / суттєвого зменшення вмісту ПТГ. Як правило, це обумовлено розвитком гіперпластичних вузлів в паращитовидній залозі, які експресують мала кількість КР і ВР і тому не чутливі до кальцію і терапії активним вітаміном D. В таких випадках рекомендується візуалізація паращитовидних залоз. Для виявлення і оцінки розмірів ПТГ використовується УЗД (+ кольоровий допплер), сцинтиграфія з Тс99m, МРТ і КТ. Якщо одна із залоз> 1,0 см в діаметрі, за даними УЗД, або рівень паратгормону перевищує 600-800 пг / мл, слід очікувати резистентності до терапії кальцитріолом. Збільшення в розмірах понад 3 залоз з ознаками вузликової гіперплазії вимагає розгляду питання про призначення цинакальцета або про проведення паратиреоїдектомії оперативним шляхом або за допомогою склерозуючою ін'єкції.
KDIGO® (2009) [2] визначає порядок лікування кісток бісфосфонатами, іншими препаратами для лікування остеопорозу і гормоном росту. Пацієнтам з ХХН 1-2-й стадії з остеопорозом і / або високим ризиком переломів за критеріями Всесвітньої організації охорони здоров'я рекомендується таке ж лікування, як і для загальної популяції (1А). Пацієнтам з ХХН 3-й стадії з рівнем ПТГ в межах нормальних значень і остеопорозом і / або високим ризиком переломів за критеріями Всесвітньої організації охорони здоров'я пропонується таке ж лікування, як і для загальної популяції (2В). У пацієнтів з ХХН 3-й стадії з біохімічними змінами внаслідок ХХН-МКН і низькою МПК і / або патологічними переломами пропонується при виборі лікування враховувати вираженість і оборотність біохімічних порушень і прогресування ХХН з обговоренням виконання біопсії кістки (2D). У пацієнтів з ХХН 4-5D стадій з біохімічними порушеннями внаслідок ХХН-МКН і низькою МПК і / або патологічними переломами пропонується проведення додаткового обстеження з біопсією кістки до призначення терапії антирезорбтивними препаратами (2С). У дітей і підлітків з ХХН 2-5D стадій і супутнім відставанням у рості при бажанні додаткового зростання ми рекомендуємо лікування рекомбінантним людським гормоном росту після вирішення питань, пов'язаних з дефіцитом харчування і біохімічними порушеннями внаслідок ХХН-МКН (1А).
У KDIGO® (2009) [2] сформульовані оцінка і лікування хвороби кісток після трансплантації нирки. У пацієнтів в ранньому посттрансплантаційному періоді рекомендується вимірювання рівня сироваткового кальцію і фосфату принаймні щотижня, до стабілізації (1B). У пацієнтів після раннього періоду після трансплантації нирки частоту моніторування рівня сироваткового кальцію, фосфату і ПТГ доцільно засновувати на наявність і ступінь вираженості порушень, а також швидкості прогресування ХХН (рівень доказовості не класифікується).
Доцільними інтервалами моніторування можуть бути:
- при ХХН 1-3Т стадій, для сироваткового кальцію і фосфату - кожні 6-12 місяців і для ПТГ - одноразово, з подальшими інтервалами між вимірами в залежності від початкового рівня і прогресування ХХН;
- при ХХН 4Т стадії для сироваткового кальцію і фосфату - кожні 3-6 місяців і для ПТГ - кожні 6-12 місяців;
- при ХХН 5Т стадії для сироваткового кальцію і фосфату - кожні 1-3 місяці і для ПТГ - кожні 3-6 місяців;
- при ХХН 3-5т стадій вимір лужноїфосфатази щорічно або частіше, при наявності підвищеного рівня ПТГ.
У пацієнтів з ХХН, які отримують терапію з приводу ХХН-МКН, або у тих, у кого виявлені біохімічні порушення, доцільно збільшити частоту вимірювань для контролю ефективності та побічних ефектів терапії (рівень доказовості не класифікується). Доцільно проводити лікування цих порушень так само, як у пацієнтів з ХХН 3-5-й стадій (рівень доказовості не класифікується).
KDIGO® (2009) [2] пропонує, щоб у пацієнтів із ХХН 1-5т стадій було можливим вимірювання рівня 25 (OH) D (кальцидіолу) з частотою повторних вимірів в залежності від його вихідного рівня і терапії (2С). У пацієнтів з ХХН 1-5т стадій пропонується коригувати дефіцит і недостатність вітаміну D за допомогою терапевтичних стратегій, рекомендованих для загальної популяції (2С). У пацієнтів з розрахунковим рівнем швидкості клубочкової фільтрації не менше ніж 30 мл / хв на 1,73 м2, якщо вони отримують кортикостероїди або мають інші фактори ризику остеопорозу для загальної популяції, KDIGO® (2009) [2] пропонує вимірювати МПК в перші три місяці після трансплантації нирки (2D). У пацієнтів в перші 12 місяців після трансплантації нирки, з розрахунковим рівнем СКФ не менш ніж 30 мл / хв на 1,73 м2 і низькою МПК, пропонується розглядати можливість лікування вітаміном D, кальцитріолом / альфакальцидолом або бісфосфонатами (2D). Також пропонується, що наявність ХХН-МКН, на які вказують відхилення рівнів кальцію, фосфату, ПТГ, лужноїфосфатази і 25 (OH) D, має впливати на вибір терапії (2C). Доцільно обговорювати біопсію кістки для визначення тактики лікування, особливо до використання бісфосфонатів, через високу частоти розвитку адинамической хвороби кісток (рівень доказовості не класифікується).
Дані про тактику терапії після перших 12 місяців недостатні у пацієнтів з ХХН 4-5Т стадій. KDIGO® (2009) [2] пропонує не проводити рутинне вимірювання МПК, так як МПК не є предиктором ризику виникнення переломів, як і в загальній популяції, і не визначає тип хвороби кісток після трансплантації нирки (2В). У пацієнтів з ХХН 4-5Т стадій з відомою низькою МПК пропонується таке ж лікування, як у пацієнтів з ХХН 4-5-й стадій, які не отримують діаліз.
В кінці 2012 року очікується публікація оновлених рекомендацій KDIGO®, присвячених діагностиці та ведення пацієнтів з порушеннями фосфорно-кальцієвого обміну при зниженій функції нирок. Цей факт ще раз підкреслює актуальність даної проблеми та її міждисциплінарний характер з огляду на високу смертність пацієнтів від кардіоваскулярних причин.
- Kidney Disease: Improving Global Outcomes (KDIGO) CKD-MBD Work Group. KDIGO clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of chronic kidney disease-mineral and bone disorder (CKD-MBD) // Kidney International. - 2009. - 76 (Suppl 113). - S1-S130.
- http://www.kdigo.org/clinical_practice_guidelines/pdf/RussianTranslationKDIGOCKD-MBDGuidelineSummary.pdf
- Іванов Д.Д. Лекції по нефрології. - Донецьк: Видавець Заславський О.Ю., 2011. - 196 с.

