- Вступ Біологічне значення статевих стероїдів в організмі жінки дуже різнобічне. Статеві стероїди...
- Результати дослідження та їх обговорення
- Висновки
Вступ
Біологічне значення статевих стероїдів в організмі жінки дуже різнобічне. Статеві стероїди контролюють не тільки репродуктивну функцію і стан органів урогенітального тракту, а й впливають на регуляцію діяльності серцево-судинної, центральної і вегетативної нервової, кісткової та інших систем організму [1]. Проведено велику кількість досліджень, присвячених негативним змінам в організмі жінки на тлі зниження вмісту естрогенів. Переважна більшість наукових робіт стосується пацієнток перименопаузального віку, але зниження вмісту статевих стероїдів може виявлятися і у жінок репродуктивного віку [2]. Однією з причин стійкою гіпоестрогенемії є порушення функції гіпофіза (так званий гіпогонадотропний гипогонадизм). Причини гіпогонадотропного гипогонадизма можуть бути вродженими (наприклад, синдром Каллманна) або при- набутими (наприклад, наслідки оперативного / променевого лікування аденом гіпофіза) [3].
Є поодинокі повідомлення про те, що у жінок з гіпогонадотропним гипогонадизмом можуть бути порушення ліпідного і кісткового обміну [4], проте не проводилося комплексної оцінки клінічних, біохімічних і гормональних змін у жінок з даним захворюванням, а також порівняльної оцінки ізольованого гіпогонадотропного гипогонадизма і гіпогонадизму в поєднанні з іншими видами гіпофізарної недостатності (гіпопітуїтаризм). Чи не проводилося досліджень якості життя пацієнток з даним захворюванням. Крім того, недостатньо вивчені механізми порушення функції гіпоталамо-гіпофізарно-оваріальної системи, що призводять до формування центрального гипогонадизма у жінок.
Тому комплексна оцінка клінічних симптомів, гормональних і метаболічних розладів у жінок з вродженим і набутим гіпогонадотропним гипогонадизмом, вивчення причин репродуктивної дисфункції, а також розробка діагностичних і диференційно-діагностичних підходів до цієї групи хворих є актуальною проблемою.
Мета дослідження - виявлення патогенетичних, клінічних, метаболічних і гормональних особливостей гіпогонадотропного гипогонадизма у жінок репродуктивного віку, а також розробка діагностичних критеріїв гіпогонадотропного гипогонадизма.
Матеріали і методи дослідження
У дослідження увійшли 54 пацієнтки: з ідіопатичним гіпогонадотропним гипогонадизмом (n = 25), з гіпопітуїтаризмом після хірургічного втручання на хиазмально-селлярной області (n = 25), а також з синдромом первинного «порожнього» турецького сідла (n = 4). У групі жінок з гіпопітуїтаризмом у 14 було поєднання гіпогонадизму і вторинного гіпотиреозу, а у 12 - поєднання гіпогонадизму, вторинного гіпотиреозу і вторинної надниркової недостатності. На момент дослідження гіпотиреоз і гіпокортицизм були компенсовані: вміст вільного тироксину (св.Т4) склало 14,9 ± 5,8 пмоль / л, клінічних ознак надниркової недостатності у хворих не відзначалося.
Критерії включення:
- вік від 18 до 50 років;
- відсутність менструацій протягом 12 міс .;
- низький або нормальний рівень гонадотропінів;
- компенсація інших видів гіпофізарної недостатності (якщо вони є);
- відсутність прийому естроген-гестагенних препаратів протягом попередніх 12 міс.
Критерії виключення:
- наявність гормонально-активної пухлини в момент обстеження;
- наявність гіпергонадотропной аменореї;
- наявність гиперпролактінемічеського гипогонадизма (табл. 1);
- наявність вродженої множинної недостатності гормонів аденогіпофіза;
- наявність важких соматичних захворювань з ураженням печінки і нирок;
- наявність полікістозних змін яєчників.
До контрольної групи увійшли 25 практично здорових жінок, які не беруть протягом 12 місяців оральні контрацептиви, з регулярним двофазним менструальним циклом.
Ультразвукове дослідження органів малого таза проводилося всім пацієнткам з допомогою приладу Ultrasоund Scanner Type 2002 ADI The Panther фірми B & K Medical (Англія), що працює в реальному масштабі часу з використанням трансабдоминального датчика 3,5 мГц і трансвагінального датчика від 5 до 7,5 мГц. Визначалося положення матки, її розміри, оцінювалася структура міометрія; товщина, ехогенність і структура ендометрія; розмір і структура яєчників, об'єм яєчників підраховується за формулою:
V = [довжина (см) • ширина (см) • висота (см)] • 0,479,
де 0,479 - коефіцієнт поправки на еліпсоїдні.
Біохімічні дослідження проводилися за допомогою аналізатора Hitachi 912 за стандартною методикою. Визначення концентрації холестерину, ліпопротеїдів високої щільності (ЛПВЩ), ліпопротеїдів низької щільності (ЛПНЩ), ліпопротеїдів дуже низької щільності, тиреоїдних гормонів, лужної фосфатази, іонізованого Са, Р, гамма-глютамілтранспептидази, аланінамінотрансферази, аспартатамінотрансферази, лактатдегідрогенази в сироватці периферичної крові проходило при використанні стандартних наборів фірми Roche (Швейцарія). Проби для визначення цих показників забиралися в ранкові години (8-11 год) натщесерце при венепункції ліктьової вени.
Визначення концентрації естрадіолу, тестостерону, лютеїнізуючого гормону (ЛГ) і фолікулостимулюючого гормону (ФСГ), св.Т4 і тиреотропного гормону (ТТГ), пролактину проводилося за допомогою автоматизованої системи Vitrus фірми Johnson and Johnson company методом посиленої люмінесценції. Для визначення пікової секреції ЛГ і ФСГ забір крові проводився через кожні 10 хвилин протягом 4 годин в периферичної крові після установки внутрішньовенного катетера. Визначення концентрації глобуліну, що зв'язує статеві гормони (ГЗСГ), проходило за допомогою автоматизованої системи Auto-Delfia фірми Wallac (Фінляндія), дегідроепіандростерон-сульфату (ДГЕА-С) - імуноферментним методом фірми «Алкор-біо» (Росія).
Підрахунок концентрації вільного тестостерону (сТ) здійснювався за формулою:
сТ = ([T] - N [cT]) / Kt {ГСПГ - [T] + N [cT]}.
Визначення концентрації ЛГ, ФСГ і статевих стероїдів у пацієнток контрольної групи проводилося на 5-7-й день менструального циклу.
Магнітно-резонансна томографія (МРТ) головного мозку проводилася на томографі фірми Siemens (Erlangen, Німеччина) з напруженістю магнітного поля 1 Тесла. Для отримання сагиттальних, фронтальних і аксіальних зображень застосовувалися параметри TR / TE / FA = 330/12/70 (імпульсні послідовності «турбо-спін-ехо», зважені по Т1) і 5000.119.186 (імпульсні послідовності «турбо-спін-ехо» і з врахуванням Т2). Товщина зрізу становила 3 мм для сагиттальних і фронтальних зображень і 4 мм - для аксіальних зображень. Дослідження здійснювалося без попередньої підготовки в положенні лежачи на спині.
Виділення геномної ДНК з цільної венозної крові проводили, використовуючи набір реактивів DNA Prep100 (DIAtom ™) за методикою, рекомендованою виробником. Полімеразна ланцюгова реакція (ПЛР): підбір олігонуклеотидних праймерів здійснювали з даних нуклеотидної послідовності генів, наведеної в базі даних NCBI. Ампліфікацію всіх досліджуваних фрагментів генів проводили методом ПЛР. Олігонуклеотидних праймери були синтезовані метоксіфосфоамітідним методом в НПФ «Літех» та Інституті біо-органічної хімії ім. Шемякіна. Аналіз отриманих ПЛР-фрагментів здійснювали методом електрофорезу в 2,5% агарозному і / або 8% поліакриламідному гелях (ПААГ) з подальшою візуалізацією в УФ-світлі після фарбування бромистим етидієм. Метод SSCP-аналізу: пошук мутацій в послідовності, що кодує і областях екзон-інтронних з'єднань гена FGFR1 здійснювали методом аналізу конформационного поліморфізму однониткових ДНК (SSCP-аналізу) (М. Orita et al., 1989). Визначення нуклеотидної послідовності ДНК: визначення нуклеотидної послідовності ПЛР-фрагментів з виявленою при SSCP-аналізі зміненої електрофоретичної рухливістю методом прямого секвенування ДНК з використанням прямого або зворотного праймерів. Автоматичне секвенування проходило згідно з протоколом фірми-виробника на приладі ABI Prism 3100 (Applied Biosystems) в НПФ «Літех». Аналіз поліморфізму довжин рестрикційних фрагментів (ПДРФ-аналіз): для аналізу відомих точкових мутацій в генах проводився ПЛР-ПДРФ-аналіз з використанням ендонуклеаз рестрикції виробництва фірми ТОВ «Сібензім». Електрофорез в ПААГ: для оцінки результатів рестрикції використовували 8% гель з співвідношенням акриламіду і бісакріламіда 29: 1 (Т. Маніатіс з співавт., 1984). Електрофорез проводили при 15-18 В / см протягом 1-2 годин. В якості маркера молекулярної ваги використовували ДНК фага l, рестріцірованную MspI. Після поділу фрагментів гель фарбували в розчині бромистого етидія (0,1 мкг / мл в 1хТВЕ) протягом 5 хвилин.
Визначення аутоантитіл до гіпофізу проводилася за допомогою твердофазного аналізу з використанням в якості антигену мембранної фракції з гіпофіза людини.
Оцінка якості життя проводилася за допомогою «Анкети загального стану здоров'я» (General Health Questionnaire - GHQ-12), яка спрямована на виявлення мінімальних психоемоційних розладів і визначає пов'язане зі здоров'ям якість життя.
Питання були розподілені по групах:
1. Позитивні характеристики якості життя (бали від 1 до 4, максимальний бал вказує на найкращу якість життя): позитивні емоційні реакції, соціальна і фізична активність, повсякденна активність, якість сну.
2. Негативні характеристики якості життя (бали від -1 до -4, мінімальний бал - найгірший стан пацієнтки): депресія і нервозність.
3. Когнітивні функції (бали від 1 до 4, максимальний бал вказує на найкращі функції).
Проводилося підсумовування балів по кожній групі питань.
Статистична обробка отриманих результатів проводилася з використанням статистичної програми Statistica 6.0 для Windows XP із застосуванням методів варіаційної статистики. Вид розподілу оцінювався за методом Шапіро - Уїлки. Результати представлені у вигляді середніх значень і їх стандартної помилки (M ± m) у випадках з параметричними даними, а також у вигляді медіани (Me) (інтерквартільний розмах - Q25-Q75) у випадках з непараметричних даними. Для проведення кореляційного аналізу використовувався метод Спірмена. Для визначення достовірності відмінностей в разі параметричних даних використовувався Т-тест, а у випадку з непараметричних - U-тест Манна - Уїтні. Для статистичної обробки даних, отриманих при визначенні пікової секреції ЛГ і ФСГ, застосовувалися елементи дисперсійного аналізу, зокрема для визначення відмінностей між осцилляциями ЛГ і ФСГ використовувалася діаграма розсіювання. Діаграма розсіювання візуалізує залежність між двома змінними X і Y. Дані зображуються точками в двовимірному просторі, де осі відповідають змінним (X - горизонтальної, а Y - вертикальної осі).
Результати дослідження та їх обговорення
Всі пацієнтки були розподілені на 2 групи: до групи 1 увійшли 28 жінок з ізольованим гипогонадизмом, в групу 2 - 26 жінок з гіпогонадизмом в поєднанні з іншими видами недостатності гормонів аденогіпофіза (гіпопітуїтаризмом). Групи обстежених пацієнток і здорових жінок не відрізнялися за віком і часу настання менархе.
Основними скаргами у жінок в 1-й групі були убоге статеве оволосіння і недостатній розвиток молочних залоз, інші скарги зустрічалися статистично значимо рідше в порівнянні з групою 2. У групі 2 статистично значимо частіше зустрічалися скарги на слабкість, втома і швидку стомлюваність, а також на урогенітальні розлади, припливи і болю в кістках, в той час як скарги на убоге статеве оволосіння і недорозвинення молочних залоз були не характерні.
При огляді у 22 (80%) жінок 1-ї групи розвиток молочних залоз відповідало 3-5-й ст. статевого розвитку по Таннера (1968), у 6 (20%) було відзначено відсутність спонтанного розвитку молочних залоз. При гінекологічному огляді у пацієнток 1-ї групи статистично значимо частіше спостерігалися убоге статеве оволосіння, відповідне 1-2-й ст. по Таннера (1968), і пальпаторне ознаки гіпоплазії внутрішніх статевих органів, в той час як інші ознаки гіпоестрогенії зустрічалися в обох групах з однаковою частотою.
У 20 (72%) жінок 1-ї групи і 22 (82%) жінок 2-ї групи результати цитологічного дослідження мазків свідчили про різного ступеня гіпоестрогенії. Частота виявлення змін клітинного складу не відрізнялася в групі 1 і 2.
За даними ультразвукового дослідження органів малого таза у жінок в 1-й і 2-й групах була відзначена виражена гіпоплазія внутрішніх геніталій, достовірна в порівнянні з контрольною групою. Серединне маточне відлуння візуалізувалося у вигляді лінійної структури товщиною не більше 0,1 см, що свідчило про вкрай низьку функціональної активності ендометрія. Ні в однієї пацієнтки не виявлено міом матки, ендометріозу, кіст яєчників.
В обох групах не було відзначено впливу на обсяг яєчників такого фактора, як тривалість аменореї. Були виявлені позитивні кореляції середнього ступеня між концентрацією естрадіолу (r = 0,7, р = 0,000001), ФСГ (r = 0,6, p = 0,000002), ЛГ (r = 0,55, р = 0, 0001) в сироватці крові і об'ємом яєчників в групах у обстежених жінок.
При огляді у жінок обох груп молочні залози були безболісні, виділень з сосків при натисканні не було. За висновком рентгенологічного / ультразвукового дослідження молочних залоз гіпоплазія тканини молочної залози і фіброзно-кістозна гіпоплазія зустрічалися з однаковою частотою.
У пацієнток в групі з ізольованим гіпогонадотропним гипогонадизмом зазначалося статистично значуще зниження концентрації ЛГ, в той час як концентрація ФСГ статистично значуще не відрізнялася від контрольної групи.
У групі з гіпопітуїтаризмом зниження концентрацій як ЛГ, так і ФСГ було статистично значущим в порівнянні з контрольною групою.
У пацієнток з нормогонадотропною аменореей (n = 11) статистично значущих відмінностей від контрольної групи виявлено не було: концентрації ЛГ і ФСГ склали 3,6 (3,14; 5,3) Е / л і 4,9 (3,9; 5 , 7) Е / л відповідно. У той час як у жінок з ізольованим гипогонадизмом (n = 17) статистично значимо знижені базальні концентрації в порівнянні з контрольною групою: ЛГ 0,1 (0,1; 0,7) Е / л, ФСГ 1,5 (0,4 ; 2,1) Е / л (р = 0,00004, р = 0,0001 відповідно).
При дослідженні пікової секреції ЛГ і ФСГ було виявлено достовірне зниження концентрацій ЛГ у пацієнток з нормогонадотропною аменореей (n = 6) у порівнянні зі здоровими жінками (3,2 (2,1; 4,1) vs 8,29 (6,35; 9,1) відповідно; р = 0,016), при цьому значних відмінностей базальної концентрації ФСГ відзначено не було (5,1 (3,4; 6,4) vs 6,55 (5,8; 8,2) відповідно; р = 0,87).
При побудові діаграм розсіювання було виявлено достовірне зниження осциляцій як ЛГ (р = 0,00004), так і ФСГ (р = 0,00004) між пацієнтками з нормогонадотропною аменореей і здоровими жінками.
У групі 1 викид ЛГ після введення аналогів гонадотропін-рилізинг-гормону (ГнРГ) був статистично значимо нижче в порівнянні з контрольною групою (16,05 (6,4; 42,1) Е / л vs 43,4 (35,8; 61,0) Е / л відповідно; р = 0,019). Відмінностей у викиді ФСГ виявлено не було (15,4 (8,2; 20,1) Е / л vs 19,4 (14; 26,2) Е / л відповідно; р = 0,94).
У групі 2 у відповідь на введення аналога гонадолиберина викид ЛГ і ФСГ був статистично значимо знижений в порівнянні з контрольною групою (р = 0,0001 і р = 0,0001 відповідно).
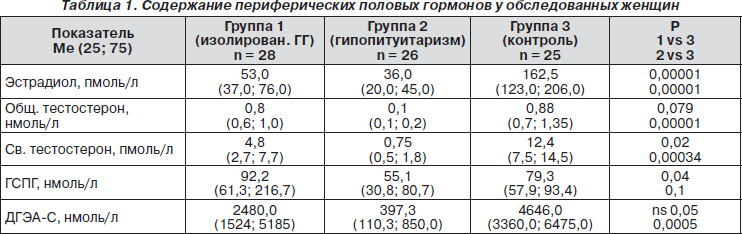
У всіх пацієнток з гіпогонадизмом як в 1-й, так і в 2-й групі спостерігалося виражене, статистично достовірне зниження концентрацій естрадіолу (табл. 1). Згідно Консенсусу з діагностики андрогенної недостатності у жінок (G. Bachmann et al., Fertil Steril, 2002), показанням до діагностики андрогенної недостатності і визначення змісту вільного тестостерону є концентрація загального тестостерону в межах нижньої чверті референтних значень або нижче (тобто менш 0,825 нмоль / л). У 15 (53,6%) пацієнток 1-ї групи і всіх пацієнток (100%) 2-ї групи були підстави для подальшого дослідження андрогенів. Проте медіана концентрацій загального тестостерону була статистично знижена тільки у пацієнток 2-ї групи, в той час як в групі 1 і 3 ці показники статистично значимо не відрізнялися. Так як в нашому дослідженні застосовувалися імуноферментні методи визначення гормонів, визначення концентрацій вільного тестостерону розраховувалося за формулою, що вимагає визначення концентрацій ГЗСС. У групі 1 зафіксовано підвищений вміст ГЗСГ, статистично значимо відрізняється від показників груп 2 і 3. Розрахунок вмісту вільного тестостерону показав, що у пацієнток обох груп є значне зниження концентрації цього гормону, статистично значуще в порівнянні з контрольною групою (табл. 1).
Незважаючи на те що концентрація ДГЕА-С у пацієнток в групі 1 статистично значуще не відрізнялася від контрольної групи, у 21 (75%) жінки його зміст знаходилося в межах нижньої чверті і навіть нижче нижньої межі референтних значень. Такі показники зустрічалися в групі 1 статистично значимо частіше в порівнянні з контрольною групою (n = 12, 48%, 1 vs 3 р = 0,0002). Зменшення концентрації ДГЕА-С може пояснюватися зниженням змісту ЛГ у цієї когорти жінок. У дослідженні була виявлена пряма статистично значуща кореляційна залежність між концентрацією ДГЕА-С і ЛГ (r = 0,54; p = 0,0005).
У всіх пацієнток 2-ї групи концентрація ДГЕА-С була нижче референтних значень, причому це не корелювало з наявністю і ступенем вираженості надниркової недостатності. Медіана концентрації ДГЕА-С була статистично значимо нижче, ніж в групі 1 і в контрольній групі.
При дослідженні GnRHR, FGFR1, FSHb мутацій виявлено не було. У двох зразках гена рецептора до ГнРГ виявлений поліморфізм Ser151Ser (AGC-AGT), що не приводить до заміни амінокислоти і описаний в літературі. Функціонального значення цей поліморфізм не має.
Ні в одному з досліджуваних зразків крові не виявлена мутація в гені FSHB. В одному зразку виявлено заміна Т-С в гетерозиготному стані. Дана заміна є одним з описаних поліморфізмів, що не приводять до заміни амінокислот Y76Y.
У 5 з 15 пацієнток (33,3%) 1-ї групи, у 4 з 11 (36,3%) 2-ї групи і у 1 з 19 здорових жінок (5,2%) було виявлено присутність антігіпофізарних аутоантитіл (АГАТ ). Частота виявлення АГАТ була достовірно вище в 1-й і 2-й групі в порівнянні з контрольною групою і не відрізнялася при порівнянні між досліджуваними групами. У всіх пацієнток 2-ї групи причиною виникнення гіпогонадизму була операція на хиазмально-селлярной області, тому у них не можна виключити формування вторинних АГАТ, проте ні в однієї з пацієнток 1-ї групи в анамнезі не було втручань на хиазмально-селлярной області. З 5 пацієнток 1-ї групи, що мають АГАТ, у 2 жінок ніяких змін хиазмально-селлярной області (за даними МРТ) відмічено не було, у 3 візуалізувалося первинне «пусте» турецьке сідло. Отримані результати вказують на те, що порушення гуморального аутоиммунитета можуть бути однією з причин формування гіпогонадотропного гипогонадизма.
Частота виявлення зниження мінеральної щільності кісткової тканини (МЩКТ) в обох групах істотно не розрізнялася, проте в 1-й групі статистично значимо частіше відзначалося ураження шийки стегна (44% vs 36%, p = 0,016), а також двох відділів одночасно (р = 0,04). У той час як в групі 2 статистично значимо частіше зустрічалися зміни в хребті (р = 0,004) в порівнянні з групою 1.
У пацієнток 1-ї групи статистично значимо частіше в порівнянні з групою 2 спостерігалася остеопения поперекових хребців (р = 0,000001); остеопенія і остеопороз стегнової кістки (р = 0,019 і р = 0,0018 відповідно). Остеопороз в поперековому відділі хребта був виявлений в групі 2 статистично значимо частіше в порівнянні з групою 1 (р = 0,000001).
У групі 2 була виявлена пряма залежність МЩКТ (в г / см2) від концентрації загального тестостерону (r = 0,62, p <0,05). При цьому достовірної залежності між МЩКТ і концентрацією естрогенів отримано не було.
У 13 (46,8%) пацієнток 1-ї групи вміст загального холестерину перевищувало референтні значення, у 5 (17,8%) вміст ЛПНЩ перевищував референтні значення, проте в цілому достовірних відмінностей від контрольної групи за цими показниками виявлено не було. Також не було відзначено достовірного зміни вмісту ЛПВЩ і тригліцеридів.
У групі 2 у 17 (64%) пацієнток показники загального холестерину, у 6 (24%) - тригліцеридів і у 9 (40%) - ЛПНЩ перевищували референтні значення. Всі ці показники достовірно перевищували значення в контрольній групі. Крім того, в групі з гіпопітуїтаризмом було виявлено зниження ЛПВЩ.
В обох групах була виявлена негативна статистично значуща залежність між концентраціями периферичних статевих стероїдів і вмістом ліпідів:
1. Естрадіол:
а) тригліцериди: r = -0,44; p = 0,009.
2. Загальний тестостерон:
а) ЛПВЩ: r = 0,34; p = 0,02;
b) холестерин: r = -0,4; p = 0,03;
c) тригліцериди: r = -0,4; p = 0,005.
3. Вільний тестостерон:
a) ЛПВЩ: r = 0,33; p = 0,04;
b) холестерин: r = -0,4; p = 0,04;
c) тригліцериди: r = -0,34; p = 0,03.
В результаті проведеного дослідження було виявлено статистично значуще зниження позитивних характеристик якості життя в групах 1 та 2 в порівнянні з контрольною групою (р = 0,026 і р = 0,00005 відповідно). При цьому зниження когнітивних функцій в обох групах відзначено не було.
Деякі характеристики якості життя прямо залежали від концентрацій периферичних статевих гормонів в крові:
1. Естрадіол:
а) рівень соціальної і фізичної активності: r = 0,45; p = 0,0035;
b) якість сну: r = 0,33; p = 0,04;
2. Загальний тестостерон:
а) рівень соціальної і фізичної активності: r = 0,54; p = 0,000003;
b) якістю сну: r = 0,47; p = 0,02.
3. Вільний тестостерон:
а) рівень соціальної і фізичної активності: r = 0,6; p = 0,00004;
b) якість сну: r = 0,46; p = 0,003;
з) рівень позитивних емоційних реакцій: r = 0,33; p = 0,04.
4. ДГЕА-С:
а) рівень соціальної і фізичної активності: r = 0,5; p = 0,0009;
b) якість сну: r = 0,45; p = 0,00;
з) рівень позитивних емоційних реакцій: r = 0,46; p = 0,003;
d) рівень повсякденної активності: r = 0,56, p = 0,0002.
При аналізі негативних показників якості життя було відзначено їх підвищення в групах 1 та 2 в порівнянні з контрольною групою. У групі 1 підвищення негативних характеристик якості життя було менш вираженим у порівнянні з групою 2 і статистично недостовірним в порівнянні з контрольною групою. У групі 2 підвищення нервозності, дискомфорту і депресії статистично значимо відрізнялося від показників контрольної групи (р = 0,0007). При проведенні кореляційного аналізу були виявлені достовірні зворотні кореляційні залежності між концентраціями естрадіолу, загального і вільного тестостерону і ДГЕА-С в крові і рівнем депресивності, почуттям дискомфорту і нервозності у обстежених жінок:
1. Естрадіол:
a) депресивність: r = -0,33; p = 0,04;
b) нервозність: r = -0,44; p = 0,005.
2. Загальний тестостерон:
a) депресивність: r = -0,67; p = 0,000003;
b) нервозність: r = -0,57; p = 0,0001.
3. Вільний тестостерон:
a) депресивність: r = -0,7; p = 0,000002;
b) нервозність: r = -0,6; p = 0,00004.
4. ДГЕА-С:
a) депресивність: r = -0,55; p = 0,0002;
b) нервозність: r = -0,45; p = 0,004.
Висновки
1. У пацієнток з гіпогонадотропним гипогонадизмом стан органів малого таза (за даними УЗД і цитологічної картині мазків) і молочних залоз вказує на виражену гіпоестрогенії. При ізольованому гипогонадизме статистично значимо частіше зустрічаються скарги на недорозвинення вторинних статевих ознак, у той час як при гіпопітуїтаризмі на перший план виходять загальні неспецифічні скарги. При гіпогонадотропного гипогонадизме відзначається зниження концентрації не тільки естрадіолу, а й андрогенів: при ізольованому гипогонадизме статистично значимо знижені медіани концентрацій вільного тестостерону, при гіпопітуїтаризмі - загального і вільного тестостерону, ДГЕА-С.
2. При гіпогонадотропного гипогонадизме відзначається зниження МЩКТ менш -1 SD в поперековому відділі хребта у 63% пацієнток. У групі з ізольованим гіпогонадотропним гипогонадизмом статистично значимо частіше виявлялися зміни МЩКТ в стегнової кістки, остеопороз зустрічався статистично значимо частіше при гіпопітуїтаризмі. При гіпогонадотропного гипогонадизме статистично значимо частіше відзначається підвищення вмісту холестерину в порівнянні зі здоровими жінками. При гіпопітуїтаризмі є більш виражені зміни ліпідного спектра: статистично значуще підвищення медіан концентрацій всіх атерогенних ліпідних фракцій, зниження медіани концентрації ЛПВЩ. Концентрація тригліцеридів, холестерину і ЛПВЩ прямо статистично значимо залежить від вмісту естрадіолу, загального і вільного тестостерону.
3. У пацієнток з ізольованим ідіопатичним при генетичному аналізі генів рецептора до гонадотропінрілізінг гормону, гена b-субодиниці ФСГ, гена FGRF виявлені випадки поліморфізму: ГнРГ (AGC-AGT) Ser151Ser; b-cyб'едініци ФСГ (TAT-TAC) Y76Y, які, однак, не можуть вважатися причиною захворювання. Частота виявлення аутоантитіл до гіпофізу при гіпогонадотропного гипогонадизме статистично значимо вище в порівнянні з контрольною групою, що свідчить про порушення гуморального аутоиммунитета у частині жінок.
4. У жінок з гіпогонадотропним гипогонадизмом відзначається зниження якості життя, найбільш виражене при гіпопітуїтаризмі. Зниження позитивних і збільшення негативних характеристик якості життя прямо залежить від концентрацій естрадіолу, загального і вільного тестостерону, а також ДГЕА-С.

