Стаття опублікована на с. 164-168
Антибіотики - надзвичайно важливі лікарські засоби для боротьби з бактеріальними інфекціями. Введення в медичну практику слова «антибіотик» співпало з відкриттям першого аминогликозида стрептоміцину в 1944 році і належить лауреату Нобелівської премії професора С.Д. Ваксмана. Після впровадження антибактеріальних препаратів в практичну медицину вони стали розглядатися як медикаменти, здатні виліковувати всі проблемні інфекційні захворювання.
У ранню епоху їх застосування часто смертельні туберкульоз і сепсис, пневмонія, менінгіти та ін. Лікувалися із застосуванням бензилпеніциліну і стрептоміцину. Застосовуючи ці антибіотики, хірургія значно розширила свої можливості в боротьбі з гнійно-запальними захворюваннями.
Але мікроорганізми еволюціонували, швидко виробляючи нові механізми стійкості до постійно з'являються в клінічній практиці антибактеріальних засобів. І вже через 6 років після початку застосування бензилпеніциліну, в 1943 р, в британських лікувальних установах стали реєструвати більше 50% пеніцилін стафілококів.
На сьогоднішній день для лікування більшості позалікарняних бактеріальних інфекцій ще є високоактивні антибіотики, але ситуація з внутрішньолікарняними полірезистентними мікроорганізмами набагато гіршими.
Суспільство інфекційних хвороб Америки визначило 6 ключових, проблемних в плані надмірного поширення в стаціонарах і широкої стійкості до антибіотиків нозокоміальних патогенів: Pseudomonas aeruginosa, Acinetobacter baumannii, метицилінрезистентний Staphylococcus aureus (MRSA), ванкоміцінрезістентний Enterococcus faecium і продукують бета-лактамази розширеного спектру ентеробактерії (переважно Escherichia coli і Klebsiella spp.).
Світова спільнота передбачало широке поширення грамположительной мікробіологічної флори, і особливо метіціллінрезістентних. Були виведені на фармацевтичний ринок: ванкоміцин і тейкопланін, даптоміцином, лінезолід, тігеціклін і цефалоспорин V покоління (зінфоро).
Що стосується інфекцій, викликаних грам-негативної мікробіологічної флорою, то спектр препаратів для їх лікування значно обмежений. Лідером по непереможності є синьогнійна паличка. Хочеться нагадати, що ж являє собою синьогнійна паличка.
Синьогнійна паличка - грам бактерія, вкрай невимоглива до умов існування. Вона має безліч факторів патогенності, стійка до цілого ряду широко застосовуваних антибіотиків (наприклад, до пеніцилінів без антисинегнойной активності, макролідів, тетрацикліну, хлорамфеніколу, ко-тримоксазолу і т.д.) і викликає інфекції переважно у тяжкохворих і іммунокомпрометірованних пацієнтів. Даний мікроорганізм характеризується повсюдним поширенням в навколишньому середовищі, особливо в місцях скупчення вологи, виділяючись з ґрунту, води і рослин. В умовах стаціонару синьогнійна паличка здатна колонізувати вологі ділянки тіла пацієнтів (промежину, пахвові западини, вушні раковини, слизові оболонки порожнини носа, ротоглотки, шлунково-кишковий тракт). В середньому частота колонізації госпіталізованих пацієнтів варіює від 2,6 до 24,0%, значно зростаючи на тлі проведеної пацієнтам антибактеріальної терапії. Однак найбільш значима колонізація синьогнійної палички поверхонь об'єктів навколишнього середовища стаціонарів і застосовуваного лікувально-діагностичного обладнання, а також шкіри, слизових і уніформи медичного персоналу. Так, згідно з даними Agodi et al., Екзогенний джерело є причиною щонайменше 59,5% колонізації і інфекцій, викликаних синьогнійної паличкою, у пацієнтів ВРІТ.
Завдяки своєму широкому поширенню в навколишньому середовищі стаціонарів і постійному впливу антибіотиків і дезінфектантів ( «селективний пресинг») сьогодні нозокоміальні ізоляти синьогнійної палички демонструють практично всі відомі механізми стійкості до антиінфекційним препаратів. Це створює значні труднощі при виборі адекватної емпіричної терапії полірезистентною синьогнійної інфекції, приводячи до зростання летальності, збільшення тривалості госпіталізації, множинним інвазивним лікувально-діагностичним втручанням і економічних втрат.
Ізоляти синьогнійної палички є мультирезистентними, якщо вони демонструють стійкість щонайменше до одного антибактеріальних препаратів в 3 і більше категоріях антибіотиків; надмірно резистентними, якщо є стійкість принаймні до 1 препарату у всіх категоріях, за винятком однієї-двох; і панрезістентним, якщо ізолят демонструє стійкість до всіх антибіотиків у всіх категоріях антимікробних препаратів. У даній публікації ми розглянемо можливості антибактеріальної терапії мульти- і надмірно резистентних інфекцій, викликаних синьогнійної паличкою.
Як правило, антибактеріальна терапія починається емпірично. Вибір антибактеріального препарату для терапії нозокоміальної синьогнійної інфекції повинен грунтуватися на даних мікробіологічного паспорта, а також на наявність у пацієнта факторів ризику інфікування мультирезистентними збудниками.
Фактори ризику інфікування множинне стійкими ізолятів синьогнійної палички значно варіюють в залежності від досліджуваної когорти пацієнтів і особливостей функціонування системи інфекційного контролю в стаціонарах. За даними проведених досліджень, найбільш часто зустрічалися такі фактори ризику: попереднє застосування у даного пацієнта антибактеріальних препаратів в найближчі 2 тижні - 6 місяців, наявність колонізації / інфекції синьогнійної палички в найближчі 6-12 місяців, тривалість госпіталізації, перебування в ВРІТ, штучна вентиляція легенів , використання сечових катетерів та ін., вторинні імунодефіцити будь-якого генезу і т.д.
Слід зазначити, що в разі превалювання в окремо взятому стаціонарі мультирезистентних форм синьогнійної палички емпіричний вибір антибактеріального препарату вкрай утруднений, так як даний збудник здатний демонструвати самі непередбачувані фенотип стійкості. У цьому випадку особливого значення набуває локальний мікробіологічний моніторинг поширення резистентних ізолятів збудника.
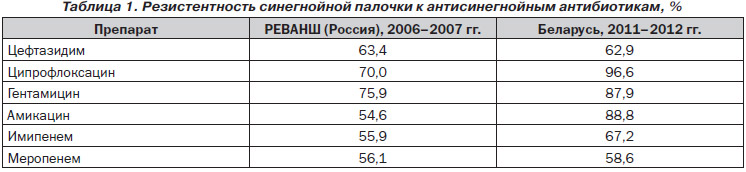
За даними мікробіологічного моніторингу 2006-2007 рр. в Росії, а також більш пізнього, 2011-2012 рр., проведеного в Білорусі, можна зробити висновок, що резистентність синьогнійної палички до вищенаведених антибіотиків досить висока - понад 50% і з роками збільшилася в середньому на 21% (табл. 1). Автори, які проводили дослідження в Білорусії в 2011-2012 рр., Відзначають відсутність резистентності до поліміксину.
В Українському центрі інтенсивної терапії сепсису (УМЦІТС) протягом більше 20 років проводиться мікробіологічний моніторинг ізолятів, виділених в центрі з різних середовищ: крові, сечі, ран та ін., Що дає важливу інформацію для раціональної антибіотикотерапії як емпірично, так і з урахуванням висіяної мікробіологічної флори.
На основі мікробіологічних і клінічних даних регулярно змінювався перелік антибіотиків, чутливість до яких визначалася пріоритетно.
Визначення мікробіологічної чутливості в центрі в основному відбувається диск-дифузійним методом, що дозволяє змінювати пріоритети визначення мікробіологічної чутливості актуальних антибіотиків.
Антибіотикочутливість Ps.аur. в УМЦІТС, 2013 р п127:
Имипенем - 71,5%
Меропенем - 54,3%
Доріпенем- 49,7%
Цефтазидим - 73,1%
Цефоперазон - 69,2%
Цефепім - 78,0%
Ципрофлоксацин - 88,9%
Левофлоксацин - 68,8%
Амікацин - 54,3%
Поліміксин Е (Коломіцин) - 7,3%
Необхідно відзначити, що чутливість ізолятів визначалася у так званих проблемних хворих, тобто тих, які вже тривалий час перебували в тих чи інших лікувальних установах і не отримували клінічного ефекту від антибіотикотерапії.
Отримавши відповідь баклабораторії про мікробіологічної чутливості ізолятів, необхідно зробити висновок про монотерапії або комбінованої антибіотикотерапії, проте єдиним пріоритетним протизапальним препаратом є Коломіцин.
Перевага комбінованої терапії полягає в можливому синергизме при використанні декількох антибіотиків з різним механізмом дії, запобігання розвитку резистентності в процесі антибіотикотерапії. Дуже часто ми проводимо адекватну емпіричну терапію, якщо відома антибіотикочутливість патогена.
З урахуванням зростаючого значення мультирезистентності нозокоміальних збудників в наших стаціонарах абсолютно виправдана тактика деескалаціонной терапії. Деескалація є стратегією антимікробної терапії, при якій спочатку призначається препарат (препарати) з максимально широким спектром антибактеріальної активності для даної клінічної ситуації, а в подальшому, після отримання результатів мікробіологічного дослідження, відбувається зміна терапії на антибіотики більш вузького спектра дії [30]. Крім того що деескалаційна стратегія антибактеріальної терапії є економічно вигідною, вона обмежує селективний пресинг і ймовірність суперінфікування іншими мультирезистентними мікроорганізмами.
У разі синьогнійної інфекції вкрай важливим моментом є дотримання тривалості антибіотикотерапії, так як неадекватна тривалість лікування може призвести до розвитку резистентності in vivo, неефективності або клінічного рецидиву інфекції.
Рекомендована тривалість антибактеріальної терапії синьогнійної інфекції в залежності від локалізації процесу:
1. Інфекції кровотоку - від 7-10 днів в разі катетер-асоційованої бактеріємії і видалення контаминированного джерела, до 14 днів і більше у пацієнтів з нейтропенією (до усунення агранулоцитозу).
2. Інфекційний ендокардит - від 6 тижнів (в залежності від тяжкості ураження).
3. Інфекції нижніх дихальних шляхів - 14-21 день.
4. Інфекції шкіри і м'яких тканин - 10-14 днів. Інфекції кісток і суглобів - до 6 тижнів.
5. Інфекції ЦНС - від 3 тижнів і більше (в залежності від тяжкості ураження і нозологічної форми).
6. Інфекції сечової системи: цистит - 5 днів; пієлонефрит, уросепсис - 14-21 день, паранефральні абсцес - 28 днів.
При антибактеріальної терапії полірезистентних нозокоміальних інфекцій вкрай важливо враховувати і цілеспрямовано використовувати дані про фармакокінетику і фармакодинаміку антибактеріальних препаратів. У разі проміжної стійкості мікроорганізму до антибіотиків максимальне дозування препарату або модифікація режиму його введення дозволяють з великою ймовірністю досягти ерадикації збудника і одужання пацієнта. Особливо це значимо для пацієнтів в критичному стані, у яких в результаті цілого ряду патофізіологічних зрушень (набряки, гіпоальбумінемія, низький гематокрит, підвищена проникність судинного русла, порушення функції печінки і нирок) і проводиться інтенсивної терапії (великі обсяги інфузійної терапії, полипрагмазия, штучна вентиляція легких) фармакокінетика препарату і так може значно відрізнятися від описуваної в інструкції до лікарського засобу.
Далі ми розглянемо окремі групи потенційно активних антіпсевдомонадние препаратів з позицій останніх досліджень особливостей їх фармакокінетики та фармакодинаміки.
Серед бета-лактамних антибіотиків щодо перспективними препаратами для лікування мультирезистентної синьогнійної інфекції залишаються цефалоспорини III покоління з антисинегнойной активністю - цефтазидим, цефоперазон і цефоперазон / сульбактам, так як частина ізолятів P.aeuginosa, виділених в Центрі лікування сепсису, демонстрували стійкість до карбапенемам і були чутливими тільки до Коломіцин і поліміксину.
Антіпсевдомонадние активність цефоперазону вважається порівнянної з цефтазидимом, хоча даних літератури щодо його клінічної ефективності щодо синьогнійної інфекцій накопичено менше. Певною перевагою в терапії синьогнійної інфекції може мати цефоперазон / сульбактам, особливо в разі превалювання у циркулюючих ізолятів продукції бета-лактамаз, які ингибируются сульбактамом. Згідно з даними досліджень in vitro, цефоперазон / сульбактам в комбінації з іншими антибіотиками демонструє синергізм і може бути ефективним навіть в відношенні резистентних штамів синьогнійної палички.
В даний час в стаціонарах СНД спостерігається вкрай високий рівень стійкості синьогнійної палички до фторхінолонів, тому в монотерапії дана група препаратів може використовуватися тільки після підтвердження чутливості до них ізолятів P.aeruginosa in vitro.
Застосування аміноглікозидів у вигляді монотерапії можливе лише для лікування неускладненій синьогнійної інфекції сечовивідних шляхів при підтвердженої чутливості до цієї групи препаратів in vitro (у зв'язку з високою частотою придбаної стійкості). З огляду на різний субстратної профіль аміноглікозид-модифікуючих ферментів, що продукуються збудником, рекомендується визначати чутливість P.aeruginosa до кожного з аміноглікозидів одночасно. Рекомендовані режими дозування амикацина: 1 г 1 р / добу.
У зв'язку з повсюдним поширенням в стаціонарах різних країн надзвичайно стійких ізолятів грамнегативних бактерій, що демонструють нечутливість до всіх бета-лактамів, фторхинолонам і аміноглікозидів, надзвичайний інтерес для клініцистів знову представляє Коломіцин (колістин). В даний час до даного антибіотика зберігається практично 93% чутливість у цілого ряду проблемних патогенів, включаючи надзвичайно стійкі ізоляти синьогнійної палички. За даними Українського медичного центру інтенсивної терапії, сьогодні лікування мультирезистентної синьогнійної інфекції становить величезну проблему вже не тільки для лікарів відділень реанімації та інтенсивної терапії, але і для лікарів хірургічних, урологічних, травматологічних і навіть терапевтичних відділень. Тільки використання всього комплексу підходів до раціональної антибактеріальної терапії важкохворих пацієнтів з множинне стійкими інфекціями, викликаними P.aeruginosa, може допомогти не допустити подальшого зростання резистентності до антибіотиків патогена і зберегти активними залишилися антіпсевдомонадние препарати.
Список літератури
1. Dalfino L. et al. High-dose, extended-interval colistin admi-nistration in critically ill patients: is this the right dosing strategy? A preliminary study / L. Dalfino et al. // Clinical infectious diseases: an official publication of the Infectious Diseases Society of America. - 2012. - Vol. 54, № 12. - P. 1720-1726.
2. Couet W. et al. Colistin pharmacokinetics: the fog is lifting / W. Couet et al. // Clinical microbiology and infection: the official publication of the European Society of Clinical Microbiology and Infectious Diseases. - 2012. - Vol. 18, № 1. - P. 30-39.
3. Calfee DP Crisis in hospital-acquired, healthcare-associated infections / DP Calfee // Annual review of medicine. - 2012. - Vol. 63. - P. 359-371.
4. Plachouras D. et al. Population pharmacokinetic analysis of colistin methanesulfonate and colistin after intravenous administration in critically ill patients with infections caused by gram-negative bacteria / D. Plachouras et al. // Antimicrobial agents and chemotherapy. - 2009. - Vol. 53, № 8. - P. 3430-3436.
5. Bergen PJ et al. Synergistic killing of multidrug-resistant Pseudomonas aeruginosa at multiple inocula by colistin combined with doripenem in an in vitro pharmacokinetic / pharmacodynamic model / PJ Bergen et al. // Antimicrobial agents and chemotherapy. - 2011. - Vol. 55, № 12. - P. 5685-5695.
6. Mena KD & Gerba CP Risk assessment of Pseudomonas aeruginosa in water / KD Mena, CP Gerba // Reviews of Environmental Contamination and Toxicology. - 2009. - Vol. 201. - P. 71-115.
7. Park YS et al. Acquisition of extensive drug-resistant Pseudomonas aeruginosa among hospitalized patients: risk factors and resistance mechanisms to carbapenems / YS Park et al. // The Journal of hospital infection. - 2011. - Vol. 79, № 1. - P. 54-58
8. Blanc DS Francioli P. & Zanetti G. Molecular Epidemiology of Pseudomonas aeruginosa in the Intensive Care Units - A Review / DS Blanc, P. Francioli, G. Zanetti // The Open Microbiology Journal. - 2007. - Vol. 1. - P. 8-11.
9. Boyer A. et al. Pseudomonas aeruginosa acquisition on an intensive care unit: relationship between antibiotic selective pressure and patients 'environment / A. Boyer et al. // Critical Care (London, England). - 2011. - Vol. 15, № 1. - P. R55.
10. Agodi A. et al. Pseudomonas aeruginosa carriage, colonization, and infection in ICU patients / A. Agodi et al. // Intensive Care Medicine. - 2007. - Vol. 33, № 7. - P. 1155-1161.
11. Poole K. Pseudomonas aeruginosa: resistance to the max / K. Poole // Frontiers in Microbiology. - 2011. - Vol. 2. - P. 65.
12. Aloush V. et al. Multidrug-resistant Pseudomonas aeruginosa: risk factors and clinical impact / V. Aloush et al. // Antimicrobial Agents and Chemotherapy. - 2006. - Vol. 50, № 1. - P. 43-48.
13. Giske CG et al. Clinical and economic impact of common multidrug-resistant gram-negative bacilli / CG Giske et al. // Antimicrobial agents and chemotherapy. - 2008. - Vol. 52, № 3. - P. 813-821.
14. Paterson DL Impact of antibiotic resistance in gram-negative bacilli on empirical and definitive antibiotic therapy / DL Paterson // Clinical infectious diseases: an official publication of the Infectious Diseases Society of America. - 2008. - Vol. 47, suppl 1. - P. S14-20.
15. Magiorakos A.-P. et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance / A.-P. Magiorakos et al. // Clinical microbiology and infection: the official publication of the European Society of Clinical Microbiology and Infectious Diseases. - 2012. - Vol. 18, № 3. - P. 268-281.
16. Peña, C. et al. Carbapenem-resistant Pseudomonas aeruginosa: factors influencing multidrug-resistant acquisition in non-critically ill patients / C. Peña et al. // European Journal of Clinical Microbiology & Infectious Diseases: Official Publication of the European Society of Clinical Microbiology. - 2009. - Vol. 28, № 5. - P. 519-522.
17. Rossolini GM & Mantengoli E. Лікування та контроль важких інфекцій, викликаних мультирезистентним Pseudomonas aeruginosa / GM Rossolini, E. Mantengoli // Клінічна мікробіологія та інфекція: офіційна публікація Європейського товариства клінічної мікробіології та інфекційних хвороб. - 2005. - Вип. 11, suppl. 4. - С. 17–32.
18. Kumar A. et al. Вигода від виживаності комбінованої антибактеріальної терапії для серйозних інфекцій, пов'язаних з сепсисом і септичним шоком, залежить лише від ризику смерті: мета-аналітичного / метарегресійного дослідження / A. Kumar et al. // Критична медична допомога. - 2010. - Вип. 38, № 8. - С. 1651–1664.
19. Traugott KA et al. Монотерапія або комбінована терапія? Головоломка Pseudomonas aeruginosa / KA Traugott et al. // Фармакотерапія. - 2011. - Вип. 31, № 6. - С. 598–608.
20. Pankuch GA et al. Активність меропенему з і без ципрофлоксацину і колистину проти Pseudomonas aeruginosa і Acinetobacter baumannii / GA Pankuch et al. // Антимікробні засоби та хіміотерапія. - 2008. - Вип. 52, № 1. - С. 333–336.
21. Bergen PJ et al. Клінічно значущі плазмові концентрації колистину в комбінації з іміпенем підвищують фармакодинамічну активність проти множинної лікарської стійкості до Pseudomonas aeruginosa при множинних інокуляціях / PJ Bergen et al. // Антимікробні засоби та хіміотерапія. - 2011. - Вип. 55, № 11. - С. 5134–5142.
22. Gunderson, BW et al. Синергічна активність колістину і цефтазидиму проти резистентного до мультиантибиотиков Pseudomonas aeruginosa в фармакодинамічній моделі in vitro / BW Gunderson et al. // Антимікробні засоби та хіміотерапія. - 2003. - Том. 47, № 3. - С. 905–909.
23. Llanes C. et al. Клінічні штами Pseudomonas aeruginosa перевикористовують одночасно насоси витікання MexAB-OprM і MexXY / C. Llanes et al. // Антимікробні агенти та хіміотерапія. - 2004. - Вип. 48, № 5. - С. 1797–1802.
24. Nicasio AM et al. Популяційна фармакокінетика високодозової, тривалої інфузії цефепіму у дорослих критично хворих пацієнтів з пневмонією, асоційованою з вентилятором / AM Nicasio et al. // Антимікробні агенти та хіміотерапія. - 2009. - Вип. 53, № 4. - С. 1476–1481.
25. Talbot GH et al. Погані помилки потребують наркотиків: оновлення трубопроводу розвитку з цільової групи з питань доступності антимікробних препаратів Товариства інфекційних хвороб Америки / GH Talbot et al. // Клінічні інфекційні захворювання: офіційне видання Інфекційного суспільства Америки. - 2006. - Вип. 42, № 5. - С. 657–668.
High-dose, extended-interval colistin admi-nistration in critically ill patients: is this the right dosing strategy?Монотерапія або комбінована терапія?

