Тит а н (лат. Titanium), Ti, хімічний елемент IV групи періодичної системи Менделєєва; атомний номер 22, атомна маса 47,90; має сріблясто-білий колір, відноситься до легким металам . Природний Т. складається з суміші п'яти стабільних ізотопів: 46Ti (7,95%), 47Ti (7,75%), 48Ti (73,45%), 49Ti (5,51%), 50Ti (5,34%). Відомі штучні радіоактивні ізотопи 45Ti (Ti1 / 2 = 3,09 ч, 51Ti (Ti1 / 2 = 5,79 хв) і ін.
Історична довідка. Т. у вигляді двоокису був відкритий англійським любителем-мінералогом У. Грегором в 1791 в магнітних залізистих пісках містечка Менакан (Англія); в 1795 німецький хімік М. Г. Клапрот встановив, що мінерал рутил являє собою природний оксид цього ж металу, названого їм «титаном» [у грецькій міфології титани - діти Урана (Неба) і Геї (Землі)]. Виділити Т. в чистому вигляді довго не вдавалося; лише в 1910 американський учений М. А. Хантер отримав металевий Т. нагріванням його хлориду з натрієм в герметичній сталевій бомбі; отриманий ним метал був пластичний лише при підвищених температурах і крихкий при кімнатній із-за високого вмісту домішок. Можливість вивчати властивості чистого Т. з'явилася тільки в 1925, коли нідерландські вчені А. Ван-Аркел і І. де Бур методом термічної дисоціації йодиду титану отримали метал високої чистоти, пластичний при низьких температурах.
Поширення в природі. Т. - один з поширених елементів, середній вміст його в земній корі (кларк) складає 0,57% по масі (серед конструкційних металів по поширеності займає 4-е місце, поступаючись залозу, алюмінію і магнію). Найбільше Т. в основних породах так званої «базальтової оболонки» (0,9%), менше в породах «гранітної оболонки» (0,23%) і ще менше в ультраосновних породах (0,03%) і ін. До гірських порід, збагаченим Т., відносяться пегматити основних порід, лужні породи, сиеніти і пов'язані з ними пегматити і ін. Відомо 67 мінералів Т., в основному магматичного походження; найважливіші - рутил і ільменіт (Див. також титанові руди ).
У біосфері Т. в основному розсіяний. У морській воді його міститься 1 · 10-7%; Т. - слабкий мігрант.
Фізичні властивості. Т. існує у вигляді двох аллотропических модифікацій: нижче температури 882,5 ° С стійка a-форма з гексагональними щільноупакованими гратами (а = 2,951 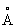 , З = 4,679
, З = 4,679 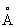 ), А вище цієї температури - b-форма з кубічної об'ємно-центрованої гратами а = 3,269
), А вище цієї температури - b-форма з кубічної об'ємно-центрованої гратами а = 3,269 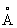 . Домішки і легуючі добавки можуть істотно змінювати температуру a / b перетворення.
. Домішки і легуючі добавки можуть істотно змінювати температуру a / b перетворення.
Щільність a-форми при 20 ° С 4,505 г / см 3 а при 870 ° С 4,35 г / см 3 b-форми при 900 ° С 4,32 г / см 3; атомний радіус Ti 1,46 ![Щільність a-форми при 20 ° С 4,505 г / см 3 а при 870 ° С 4,35 г / см 3 b-форми при 900 ° С 4,32 г / см 3; атомний радіус Ti 1,46 , Іонні радіуси Ti + 0,94 , Ti2 + 0,78 , Ti3 + 0,69 , Ti4 + 0,64 , T пл1668 ± 5 ° С, t кип 3227 ° С; теплопровідність в інтервалі 20-25 ° С 22,065 вт / (м × К) [0,0527 кал / (см × сік × ° С)]; температурний коефіцієнт лінійного розширення при 20 ° С 8,5 × 10-6, в інтервалі 20-700 ° С 9,7 × 10-6; теплоємність 0,523 кдж / (кг × К) [0,1248 кал / (г × ° С)]; питомий електроопір 42,1 × 10-6 ом × см при 20 ° С; температурний коефіцієнт електроопору 0,0035 при 20 ° С; володіє надпровідністю нижче 0,38 ± 0,01 К](/wp-content/uploads/2020/01/uk-titan-him-element-4.gif) , Іонні радіуси Ti + 0,94
, Іонні радіуси Ti + 0,94  , Ti2 + 0,78
, Ti2 + 0,78  , Ti3 + 0,69
, Ti3 + 0,69  , Ti4 + 0,64
, Ti4 + 0,64  , T пл1668 ± 5 ° С, t кип 3227 ° С; теплопровідність в інтервалі 20-25 ° С 22,065 вт / (м × К) [0,0527 кал / (см × сік × ° С)]; температурний коефіцієнт лінійного розширення при 20 ° С 8,5 × 10-6, в інтервалі 20-700 ° С 9,7 × 10-6; теплоємність 0,523 кдж / (кг × К) [0,1248 кал / (г × ° С)]; питомий електроопір 42,1 × 10-6 ом × см при 20 ° С; температурний коефіцієнт електроопору 0,0035 при 20 ° С; володіє надпровідністю нижче 0,38 ± 0,01 К. Т. парамагнитен, питома магнітна сприйнятливість (3,2 ± 0,4) × 10-6 при 20 ° С. Межа міцності 256 Мн / м 2 (25,6 кгс / мм 2), відносне подовження 72%, твердість по Брінеллю менше 1000 Мн / м 2 (100 кгс / мм 2). Модуль нормальної пружності 108000 Мн / м 2 (10800 кгс / мм 2). Метал високого ступеня чистоти ковок при звичайній температурі.
, T пл1668 ± 5 ° С, t кип 3227 ° С; теплопровідність в інтервалі 20-25 ° С 22,065 вт / (м × К) [0,0527 кал / (см × сік × ° С)]; температурний коефіцієнт лінійного розширення при 20 ° С 8,5 × 10-6, в інтервалі 20-700 ° С 9,7 × 10-6; теплоємність 0,523 кдж / (кг × К) [0,1248 кал / (г × ° С)]; питомий електроопір 42,1 × 10-6 ом × см при 20 ° С; температурний коефіцієнт електроопору 0,0035 при 20 ° С; володіє надпровідністю нижче 0,38 ± 0,01 К. Т. парамагнитен, питома магнітна сприйнятливість (3,2 ± 0,4) × 10-6 при 20 ° С. Межа міцності 256 Мн / м 2 (25,6 кгс / мм 2), відносне подовження 72%, твердість по Брінеллю менше 1000 Мн / м 2 (100 кгс / мм 2). Модуль нормальної пружності 108000 Мн / м 2 (10800 кгс / мм 2). Метал високого ступеня чистоти ковок при звичайній температурі.
Застосовуваний в промисловості технічний Т. містить домішки кисню, азоту, заліза, кремнію та вуглецю, що підвищують його міцність, що знижують пластичність і що впливають на температуру поліморфного перетворення, яке відбувається в інтервалі 865-920 ° С. Для технічного Т. марок ВТ1-00 і ВТ1-0 щільність близько 4,32 г / см 3, межа міцності 300- 550 Мн / м 2 (30-55 кгс / мм 2), відносне подовження не нижче 25%, твердість по Бринелю 1150-1650 Мн / м 2 (115-165 кгс / мм 2). Конфігурація зовнішньої електронної оболонки атома Ti 3 d 24 s 2.
Хімічні властивості. Чистий Т. - хімічно активний перехідний елемент , В з'єднаннях має ступені окислення + 4, рідше +3 і +2. При звичайній температурі і аж до 500-550 ° С корозійний стійкий, що пояснюється наявністю на його поверхні тонкої, але міцної окисної плівки.
З киснем повітря помітно взаємодіє при температурі вище 600 ° С з утворенням TiO2 (див. Також титана оксиди ). Тонка титанова стружка при недостатньому мастилі може спалахувати в процесі механічної обробки. При достатній концентрації кисню в навколишньому середовищі і пошкодженні окисної плівки шляхом удару або тертя можливе загоряння металу при кімнатній температурі і в порівняно великих шматках.
Окісна плівка не захищає Т. в рідкому стані від подальшої взаємодії з киснем (на відміну, наприклад, від алюмінію), і тому його плавка і зварювання повинні проводитися у вакуумі, в атмосфері нейтрального газу або під флюсом. Т. має здатність поглинати атмосферні гази і водень, утворюючи крихкі сплави, непридатні для практичного використання; при наявності активованої поверхні поглинання водню відбувається вже при кімнатній температурі з невеликою швидкістю, яка значно зростає при 400 ° С і вище. Розчинність водню в Т. є оборотною, і цей газ можна видалити майже повністю відпалом у вакуумі. З азотом Т. реагує при температурі вище 700 ° С, причому виходять нітриди типу TiN; у вигляді тонкого порошку або дроту Т. може горіти в атмосфері азоту. Швидкість дифузії азоту і кисню в Т. значно нижче, ніж водню. Одержуваний в результаті взаємодії з цими газами шар відрізняється підвищеними твердістю і крихкістю і повинен віддалятися з поверхні титанових виробів шляхом травлення або механічної обробки. Т. енергійно взаємодіє з сухими галогенами (див. титана галогеніди ), По відношенню до вологих галогенів стійкий, оскільки волога грає роль інгібітору.
Метал стійкий в азотній кислоті всіх концентрацій (за винятком червоної димлячої, що викликає корозійне розтріскування Т., причому реакція інколи йде з вибухом), в слабких розчинах сірчаної кислоти (до 5% по масі). Соляна, плавикова, концентрована сірчана, а також гарячі органічні кислоти: щавлева, мурашина і трихлоруксусная реагують з Т.
Т. корозійний стійкий в атмосферному повітрі, морській воді і морській атмосфері, у вологому хлорі, хлорного воді, гарячих і холодних розчинах хлоридів, в різних технологічних розчинах і реагентах, застосовуваних у хімічній, нафтовій, папероробної і ін. Галузях промисловості, а також в гідрометалургії. Т. утворює з С, В, Se, Si металлоподобниє з'єднання, що відрізняються тугоплавкостью і високою твердістю. Карбід TiG (t пл 3140 ° С) отримують нагріванням суміші TiO2 з сажею при 1900-2000 ° С в атмосфері водню; нітрид TiN (t пл 2950 ° С) - нагріванням порошку Т. в азоті при температурі вище 700 ° С. Відомі силіциди TiSi2, Ti5Si3, TiSi та бориди TiB, Ti2B5, TiB2. При температурах 400-600 ° С Т. поглинає водень з утворенням твердих розчинів і гідридів (TiH, TiH2). При сплаві TiO2 з лугами утворюються солі титанових кислот мета- і ортотітанати (наприклад, Na2TiO3 і Na4TiO4), а також політітанати (наприклад, Na2Ti2O5 і Na2Ti3O7). До титанатів відносяться найважливіші мінерали Т., наприклад ільменіт FeTiO3, перовскит CaTiO3. Все титанати малорастворіми в воді. Двоокис Т., титанові кислоти (опади), а також титанати розчиняються в сірчаної кислоти з утворенням розчинів, що містять тітанілсульфат TiOSO4. При розведенні і нагріванні розчинів в результаті гідролізу осідає H2TiO3, з якої отримують двоокис Т. При додаванні перекису водню в кислі розчини, що містять сполуки Ti (IV), утворюються перекисні (надтитанові) кислоти складу H4TiO5 і H4TiO8 і відповідні їм солі; ці сполуки пофарбовані в жовтий або оранжево-червоний колір (залежно від концентрації Т.), що використовується для аналітичного визначення Т.
Отримання. Найбільш поширеним методом отримання металевого Т. є магниетермический метод, тобто відновлення тетрахлориду Т. металевим магнієм (рідше - натрієм):
TiCl4 + 2Mg = Ti + 2MgCl2.
В обох випадках вихідною сировиною служать окисні руди Т. - рутил, ільменіт і ін. В разі руд типа ільменітов Т. в формі шлаку відділяється від заліза шляхом плавки в електропечах. Шлаки (так само, як рутил) піддають хлоруванню у присутності вуглецю з утворенням тетрахлориду Т., який після очищення надходить в відновлювальний реактор з нейтральною атмосферою.
Т. по цьому процесу виходить в губчатому вигляді і після подрібнення переплавляється у вакуумних дугових печах на злитки з введенням легуючих добавок, якщо потрібно отримати сплав. Магнієтермічеський метод дозволяє створити велике промислове виробництво Т. із замкнутим технологічним циклом, так як утворюється при відновленні побічний продукт - хлорид магнію прямує на електроліз для отримання магнію і хлору.
У ряді випадків для виробництва виробів з Т. і його сплавів вигідно застосовувати методи порошкової металургії. Для одержання особливо тонких порошків (наприклад, для радіоелектроніки) можна використовувати відновлення двоокису Т. гидридом кальцію.
Світове виробництво металевого Т. розвивалося досить швидко: близько 2 т в 1948, 2100 т в 1953, 20 000 т в 1957; в 1975 воно перевищило 50 000 т.
Застосування. Основні переваги Т. перед ін. Конструкційними металами: поєднання легкості, міцності і корозійної стійкості. Титанові сплави по абсолютній, а тим більше по питомій міцності (тобто міцності, віднесеній до щільності) перевершують більшість сплавів на основі ін. Металів (наприклад, заліза або нікелю) при температурах від -250 до 550 ° С, а по корозійності вони порівнянні зі сплавами благородних металів (див. також легкі сплави ). Однак як самостійний конструкційний матеріал Т. став застосовуватися тільки в 50-і рр. 20 в. в зв'язку з великими технічними труднощами його вилучення з руд і переробки (саме тому Т. умовно відносили до рідкісних металів ). Основна частина Т. витрачається на потреби авіаційної і ракетної техніки і морського суднобудування (див. Також титанові сплави ). Сплави Т. із залізом, відомі під назвою «ферротитан» (20-50% Т.), в металургії якісних сталей і спеціальних сплавів служать легуючої добавкою і розкислювачем.
Технічний Т. йде на виготовлення ємкостей, хімічних реакторів, трубопроводів, арматури, насосів та ін. Виробів, що працюють в агресивних середовищах, наприклад в хімічному машинобудуванні. У гідрометалургії кольорових металів застосовується апаратура з Т. Він служить для покриття виробів із сталі (див. Тітанірованіє ). Використання Т. дає в багатьох випадках великий техніко-економічний ефект не тільки завдяки підвищенню терміну служби устаткування, але і можливості інтенсифікації процесів (як, наприклад, в гідрометалургії нікелю). Біологічна нешкідливість Т. робить його чудовим матеріалом для виготовлення обладнання для харчової промисловості та в відновної хірургії. В умовах глибокого холоду міцність Т. підвищується при збереженні хорошої пластичності, що дозволяє застосовувати його як конструкційний матеріал для кріогенної техніки. Т. добре піддається поліровці, кольоровому анодуванню і ін. Методам обробки поверхні і тому йде на виготовлення різних художніх виробів, в тому числі і монументальної скульптури. Прикладом може служити пам'ятник в Москві, споруджений на честь запуску першого штучного супутника Землі. З сполук титану практичного значення мають оксиди Т., галогеніди Т., а також силіциди Т., використовувані в техніці високих температур; бориди Т. і їх сплави, що застосовуються як сповільнювачі в ядерних енергетичних установках завдяки їх тугоплавкости і великому перетину захоплення нейтронів. Карбід Т., що володіє високою твердістю, входить до складу інструментальних твердих сплавів, використовуваних для виготовлення ріжучих інструментів і як абразивний матеріал.
Двоокис титану і титанат барію служать основою титанової кераміки , А титанат барію - найважливіший сегнетоелектрік .
С. Г. Глазунов.
Титан в організмі. Т. постійно присутній в тканинах рослин і тварин. У наземних рослинах його концентрація - близько 10-4%, в морських - від 1,2 × 10-3 до 8 × 10-2%, в тканинах наземних тварин - менше 2 × 10-4%, морських - від 2 × 10 -4 до 2 × 10-2%. Накопичується у хребетних тварин переважно в рогових утвореннях, селезінці, надниркових, щитовидної залозі, плаценті; погано всмоктується з шлунково-кишкового тракту. У людини добовий вступ Т. з продуктами харчування і водою складає 0,85 мг; виводиться з сечею і калом (0,33 і 0,52 мг відповідно). Щодо малотоксичний.
Літ .: Глазунов С. Г., Моісеєв В. Н., Конструкційні титанові сплави, М., 1974; Металургія титану, М., 1968; Горощенко Я. Г., Хімія титану, [ч. 1-2], К., 1970-72; Zwicker U., Titan und Titanlegierungen, B., 1974; Bowen HIM, Trace elements in biochemistry, L.- NY, 1966.

