ФЕРМЕНТИ (від лат. Fermentum - закваска) (ензими), білки . виконують роль каталізаторів в живих організмах. Основні функції ферментів - прискорювати перетворення речовин, що надходять в організм і утворюються при метаболізмі (Для поновлення клітинних структур, для забезпечення його енергією і ін.), А також регулювати біохімічні процеси (напр., Реалізацію генетичної інформації), в тому числі у відповідь на мінливі умови.
Про механізм реакцій за участю ферментів (ферментативних реакціях) см. Ферментативний каталіз . Ферментативних реакцій кінетика.
Структуру ферментів вивчають методами хімічної модифікації, рентгенівського структурного аналізу . спектроскопії . Цінні результати отримані методом сайт-специфічного мутагенезу, основаного на спрямованої заміні амінокислот в білкової молекулі методами генетичної інженерії. До кінця 20 століття відомо і охарактеризовано близько 3000 ферменти
Історичний нарис. Початок сучасної науки про ферменти (ензимології) пов'язують з відкриттям в 1814 К. Кирхгофом перетворення крохмалю в цукор під дією водних витяжок з проростків ячменю. Чинне початок з цих витяжок було виділено в 1833 А. Пайеном і Ж. Персо. Ним виявився фермент амілаза . У 1836 році Шванн виявив і описав пепсин . в тому ж році І. Пуркіньє і І. Паппенгейм охарактеризували трипсин. У 1897 брати Г. і Е. Бухнера виділили з дріжджів розчинний препарат (так звану зимазу), що викликав спиртове бродіння. Цим було покладено край суперечці Л. Пастера (він вважав, що процес бродіння можуть викликати тільки цілісні живі клітини) і Ю. Лібіха (вважав, що бродіння пов'язане з особливими речовинами). В кінці 19 ст. Е. Фішер запропонував першу теорію специфічності ферментів. У 1913 Л. Міхаеліс сформулював загальну теорію кінетики ферментативних реакцій. У кристалічному вигляді перші ферменти були отримані Дж. Самнером в 1926 (уреаза) і Дж. Нортроп в 1930. пепсин . Вперше первинна структура (амінокислотна послідовність) ферменти була встановлена У. Стейном і С. Муром в 1960 для рибонуклеази А, а в 1969 P. Мерріфілд здійснений хімічний синтез цього ферменти Просторова будова (третинна структура) ферменти вперше встановлено Д. Філліпсом в 1965 для лізоциму . У другій половині 20 століття каталітична активність була відкрита також у деяких РНК (їх називають рибозими).
Класифікація ферментів. Історично багатьом ферменти присвоювалися тривіальні назви, часто вже не пов'язані з типом каталізруемой реакції. Для подолання труднощів, що виникли в середині 20 століття були розроблені класифікації і номенклатура ферментів По рекомендації Міжнародного біохімічного. союзу, все ферменти в залежності від типу каталізуються реакції ділять на 6 класів: 1-й - оксидоредуктаз, 2-й - трансферази . 3-й - гідролази . 4-й - ліази . 5-й - ізомерази і 6-й - лігази . Кожен клас ділиться на підкласи, відповідно до природи функціональних груп субстратів, що піддаються хімічному перетворенню. Підкласи, в свою чергу, діляться на подпод-класи в залежності від типу бере участь у перетворенні ферментів. Кожному досить охарактеризувати ферменту присвоюється класифікаційний номер з 4 цифр, позначають клас, підклас, подподкласса і номер самого ферменту. наприклад, трипсин має номер 3.4.21.1.
До Оксидоредуктази відносяться ферменти, що каталізують окислювально-відновні реакции. Ферменти цього типу переносять атоми H або електрони . багато оксидоредуктаз є ферменти дихання і окисного фосфорилювання .
Трансферази каталізують перенесення функціональних груп (CH3, COOH, NH2, CHO і ін.) Від однієї молекули до іншої.
Гідролази каталізують гідролітичні розщеплення зв'язків (пептидного, гликозидной, ефірної, фосфодіефірних і ін •) •
Ліази каталізують негідролітіческім відщеплення груп від субстрату з утворенням подвійного зв'язку і зворотні реакції. Ці ферменти можуть отщеплять CO2, H2O, NH3 та ін.
Ізомерази каталізують освіту ізомерів субстрату, в тому числі цис-, транс -ізомерізацію, переміщення кратних зв'язків . а також груп атомів всередині молекули.
Лігази - ферменти, каталізують приєднання двох молекул з утворенням нових зв'язків (С - С, С - S, С - О, С - N і ін.), Як правило, пов'язана з розщепленням пірофос-фатной зв'язку, наприклад у АТФ
Особливості будови ферментів. Молекулярна маса ферментів складає від 104 до 1010 і більше. Найчастіше зустрічаються ферменти з молекулярною масою 20-60 тисяч, більші зазвичай складаються з декількох однакових (гомомери) або різних (гетеромери) субьедініц, пов'язаних між собою нековалентними зв'язками. Субодиниця може складатися з двох і більше ланцюгів, з'єднаних дисульфідними зв'язками.
У первинній структурі однотипних ферментів, виділених навіть з еволюційно віддалених організмів, часто спостерігається певна гомологія, а деякі ділянки практично залишаються незмінними. Вторинна структура відрізняється великою різноманітністю за змістом 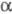 -спіралей і
-спіралей і 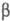 -структур (див. Білки).
-структур (див. Білки). 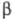 -Структури складають ядро багатьох ферментів, утворюючи "опорну" структуру. Сукупність стандартних елементів вторинних структур і специфічно покладених ділянок поліпептидного ланцюга, певним чином розташованих у просторі, утворює третинну структуру, визначальну біологічні властивості ферментів
-Структури складають ядро багатьох ферментів, утворюючи "опорну" структуру. Сукупність стандартних елементів вторинних структур і специфічно покладених ділянок поліпептидного ланцюга, певним чином розташованих у просторі, утворює третинну структуру, визначальну біологічні властивості ферментів
Третинна структура унікальна для кожного ферменту, однак у однотипних ферменти, навіть сильно відрізняються по первинній структурі, просторове розташування ланцюгів може бути подібним (напр., хімотрипсин і субтилизина). Часто в третинної структурі можна виділити окремі компактні частини (домени), з'єднані ділянками поліпептидного ланцюга. Організація в просторі декількох субодиниць визначає четвертинних структуру ферменти
На поверхні білкової глобули ферменту або, частіше, в спеціальній щілини, поглиблення і т. П. Виділяють відносно невелику ділянку, званий активним центром. Він являє собою сукупність функціональних груп амінокислотних залишків, безпосередньо взаємодіють з субстратом. В активний центр, крім функціональних груп, можуть входити небілкові складові - коферменти . Такий комплекс називають холоферменту, а його білкову частину - апоферментом. Амінокислотні залишки, що входять в активний центр, відносяться до найбільш консервативним в даній групі ферментом. В активному центрі можна виділити субстрат-зв'язуючий ділянку і власне каталитически активні групи ферменту. До останніх, наприклад, в подподкласса серії нових протеаз відносяться функціональні групи залишків серину-195, гістидину-57 і аспарагінової кислоти-102. Крім того, як каталітично активних груп ферменти виступають група SH цистеїну , Група COOH глугаміновой кислоти, фенольний гідроксил тирозину і ін., а також функц. групи коферментів - нікотинамідні кільце нікотінамідних коферментів (див. Ниацин), альдегидная група (у вигляді альдіміна) пиридоксальфосфата, тіазоліновое кільце тіамінпірофосфат, іони металів (напр., Zn2 +, Co2 +, Mn2 +) і ін.
Отримання ферментів. Зазвичай ферменти виділяють з тканин тварин, рослин, клітин і культуральних рідин мікроорганізмів, біологічних рідин (кров, лімфа і ін.). Для отримання деяких важкодоступних ферменти використовуються методи генетичної інженерії. З вихідних матеріалів ферменти екстрагують сольовими розчинами. Потім їх поділяють на фракції, облягаючи солями [зазвичай (NH4) 2SO4] або, рідше, органічними розчинниками, і очищають методами гель-проникаючої і ионо-обмінної хроматографії. На заключних етапах очистки часто використовують методи афінної хроматографії. Контроль за ходом очищення ферменту і характеристику чистих препаратів здійснюють, вимірюючи каталітичну активність ферментів з застосуванням специфічних (зазвичай дають кольорові реакції) субстратів. За одиницю кількості ферменти беруть таке його кількість, яке каталізує перетворення 1 мкмоль субстрату за 1 хв в стандартних умовах. Число одиниць ферменти, віднесене станом на 1 мг білка, наз. питомою активністю.
Застосування ферментів. У неочищеному стані ферменти з найдавніших часів застосовують щоб одержати продуктів харчування і вичинки виробів в хлібопеченні, сироваріння, виноробстві, обробці шкір і т. Д. Досить очищені ферменти застосовують у виробництві амінокислот і їх сумішей для штучного харчування, у виробництві цукрових сиропів з водневмісткої сировини, для видалення лактози з молока і у виробництві ряду лікарських засобів (деякі очищені ферменти самі використовуються як лікарські засоби). Особливо перспективним є використання в промисловості іммобілізованих ферментів на полімерних носіях (наприклад, для отримання напівсинтетичних пеніцилінів застосовують іммобілізовані пеніціллінамідазу, див. Також ферментсодержащего волокна). Про використання ферменти в хімічному аналізі см. Ферментатівниє методи аналізу.
Літ .: Номенклатура ферментів (рекомендації 1972), пров. з англ., M., 1979; Фершт Е., Структура і механізм дії ферментів, пров. з англ., M., 1980; Діксон M., Уебб Е., Ферменти, пров. з англ., т. 1-3, M., 1982; Methods in enzymology, eds. SP Colowick, NO Kaplan, NY- SF- L., 1955.
В. К. Антонов.

